No falta mucho para que comience la evaluación clínica conjunta: ¿Se hará realidad la ansiedad PICO?

¿Estás listo?
Acontecimientos recientes
Especificaciones científicas de los medicamentos
Nuevo principio activo |
Sustancia activa química, biológica o radiofarmacéutica nueva que:
|
Tratamiento del cáncer |
|
ATMP (Agente de control de |
|
Llave: ATMP – medicamento de terapia avanzada; CE – Comisión Europea; UE – Unión Europea; HTACG – Grupo de Coordinación de Evaluación de Tecnologías Sanitarias; CIE-O – Clasificación Internacional de Enfermedades Oncológicas; JCA – Evaluación Clínica Conjunta.
Actos de ejecución y documentos de orientación pendientes
Acto de ejecución |
Fecha tope |
Estado |
|
Normas de procedimiento aplicables a la JCA de medicamentos |
Q1–Q2 2024 |
Aprobada el 23 de mayo de 2024 |
|
Normas sobre cooperación mediante intercambio de información con la EMA |
3er trimestre de 2024 |
Aprobado el 18 de octubre de 2024 |
|
Normas de procedimiento para la gestión de conflictos de intereses |
3er trimestre de 2024 |
Aprobada el 25 de octubre de 2024 |
|
Normas de procedimiento aplicables a la sociedad anónima de medicamentos |
3er trimestre de 2024 |
Versión final en preparación, consulta pública cerrada |
|
Normas de procedimiento para la S.A. de productos sanitarios y productos sanitarios para diagnóstico in vitro |
4° trimestre de 2024 |
Consulta pública abierta hasta el 26 de noviembre de 2024 |
|
Normas de procedimiento para la JCA de productos sanitarios y productos sanitarios para diagnóstico in vitro |
4° trimestre de 2024 |
Planificado |
Llave: EMA – Agencia Europea del Medicamento; IVD – diagnóstico in vitro; JCA – Evaluación Clínica Conjunta; JSC – Consulta Científica Conjunta.
Además, actualmente se están preparando más de 10 documentos de orientación que se espera que se publiquen antes de que la JCA entre en vigor. Entre ellas, las partes interesadas esperan con especial impaciencia las orientaciones que describen la metodología científica para el proceso de determinación del alcance, ya que se espera que complementen las orientaciones preliminares anteriores de EUnetHTA 21 sobre cómo se llevará a cabo este «primer paso» del proceso de la JCA, como la definición del PICO (población, intervención, comparador, resultado) para el ámbito de aplicación de la JCA.
Inicio del proceso de JCA por parte del desarrollador de tecnologías sanitarias

Definición de PICO
Tabla 3. Comparación de simulaciones PICO en mCRPC por EUnetHTA 21 y Cencora
|
|
EUnetHTA 21 |
Cencora |
|
Indicación |
Pacientes adultos con cáncer de próstata metastásico resistente a la castración (CPRCm) positivo para el antígeno prostático prostático progresivo (PSMA) que han sido tratados con inhibición de la vía del receptor de andrógenos (AR) y quimioterapia basada en taxanos |
|
|
Número de Estados miembros cubiertos |
8 (Países no especificados) |
16 (Alemania, Bélgica, Dinamarca, España, Finlandia, Francia, Grecia, Irlanda, Italia, Luxemburgo, Noruega, Países Bajos, Polonia, Portugal y República Checa) |
|
Resultados (nº.) |
|
|
|
Poblaciones |
Población con licencia completa + 4 subpoblaciones |
Población con licencia completa + 4 subpoblaciones |
|
Intervención |
Pluvicto |
Cenpicomab |
|
Comparadores |
6 |
12 |
|
Resultados |
21 |
20 (véase Figura 1) |
|
PICOs consolidados |
6, incluidos 2 para la población con licencia completa |
18, incluidos 9 para la población con licencia completa (véase el cuadro 4) |
|
Fecha de la encuesta PICO |
Noviembre de 2022 |
Mayo de 2024 |
Clave: no. –número; PICO: población, intervención, comparador, resultado.
La comparación de ambas simulaciones muestra que la inclusión de una gama más amplia de Estados miembros y la ampliación del calendario para capturar los comparadores aprobados más recientemente puede dar lugar a un aumento significativo de los PICO consolidados que deben tenerse en cuenta para el ámbito de aplicación de la JCA debido a las variaciones en las directrices clínicas, los estándares de tratamiento y la velocidad de acceso al mercado de nuevos medicamentos en los países de la UE.
Comparadores
De acuerdo con la guía práctica de EUnetHTA 21, cada comparador requerido en los países incluidos da como resultado un PICO separado para el alcance de la evaluación. Siguiendo esta directriz práctica, el análisis de Cencora dio lugar a un elevado número de PICO para toda la población, impulsado por el requisito de cinco de los 16 países (Alemania, Irlanda, Italia, Portugal y España) de incluir todos los comparadores relevantes a nivel local en la evaluación clínica, cubriendo un rango de dos comparadores en Italia frente a siete en Portugal. En cambio, tres países (la República Checa, Francia y los Países Bajos) declararon que la evaluación de un elemento de comparación pertinente a nivel local era suficiente, otro país (Polonia) declaró que el elemento de comparación pertinente se seleccionaría sobre la base de la cuota de mercado más alta, y cinco países (Bélgica, Dinamarca, Finlandia, Noruega y Suecia) destacaron que la opción de tratamiento pertinente dependería del posicionamiento del producto (es decir, la línea de tratamiento) por parte del DTH. En Luxemburgo, la evaluación se basa en el expediente presentado en el «pays de provenance» oficial (es decir, el país de origen, normalmente Bélgica). En Grecia, solo se consideró pertinente un elemento de comparación para el alcance de la evaluación. En la Tabla 4 se muestran los PICOs identificados para toda la población de cenpicomab.
Para el análisis de EUnetHTA 21, no se han publicado los requisitos específicos de cada país, lo que refleja el proceso de determinación del alcance en el marco de la ACJ, en el que las respuestas de los distintos países no se pondrán a disposición de los HTD.
|
|
Comparadores de interés para toda la población para cenpicomab |
Países que solicitan cada comparador |
PICO 1 |
Abiraterona + prednisona/prednisolona |
BE, DE, FI, FR, IE, LU, NL, NO, PT, SE |
PICO 2 |
La mejor atención de apoyo* |
DE,DK, ES, FI, IE, NL, NO, SE |
PICO 3 |
Cabazitaxel + prednisona/prednisolona* |
BE, DE,DK, ES, FI, IE, IT, LU, NL, NO, PT, SE |
PICO 4 |
Docetaxel + prednisona/prednisolona* |
BE, DK, FI, IE,LU, NL, NO, PT, SE |
PICO 5 |
Enzalutamida |
BE, DE,DK, FI, FR, IE, LU, NL, NO, PT, SE |
PICO 6 |
Lutecio (177Lu) vipivotida tetraxetán + terapia de privación de andrógenos* |
BE, DE, FI, GR, IE, IT,NL, PO, PT |
PICO 7 |
Olaparib* |
DK, PT |
PICO 8 |
Radio-223* |
ES, FI, PO |
PICO 9 |
Radio-223 + hormona liberadora luteinizante análoga* |
PO, PT |
Llave: BE – Bélgica; CZ – República Checa; DE – Alemania; DK – Dinamarca; ES – España; FI – Finlandia; FR – Francia; GR – Grecia; IE – Irlanda; IT – Italia; LU – Luxemburgo; NL – Países Bajos; NO – Noruega; PICO: población, intervención, comparador, resultado; PO – Polonia; PT – Portugal; SE – Suecia.
Nota: Los países en negrita representan los países de los que se derivó el PICO debido a la solicitud de datos sobre todos los comparadores identificados.
*Los comparadores también se consideran en los PICO para subpoblaciones (no se presentan aquí).
La posibilidad de que se produzcan PICO extensos como resultado de la fase de alcance se confirmó en una simulación reciente de la EFPIA para tres tratamientos oncológicos autorizados, incluidos los huérfanos y los ATMP, lo que dio lugar a un gran número de PICO potenciales en siete países, que oscilan entre siete y 23 PICO después de la consolidación.
Resultados
Figura 1. Número de países que solicitan datos en función de los resultados clínicos especificados
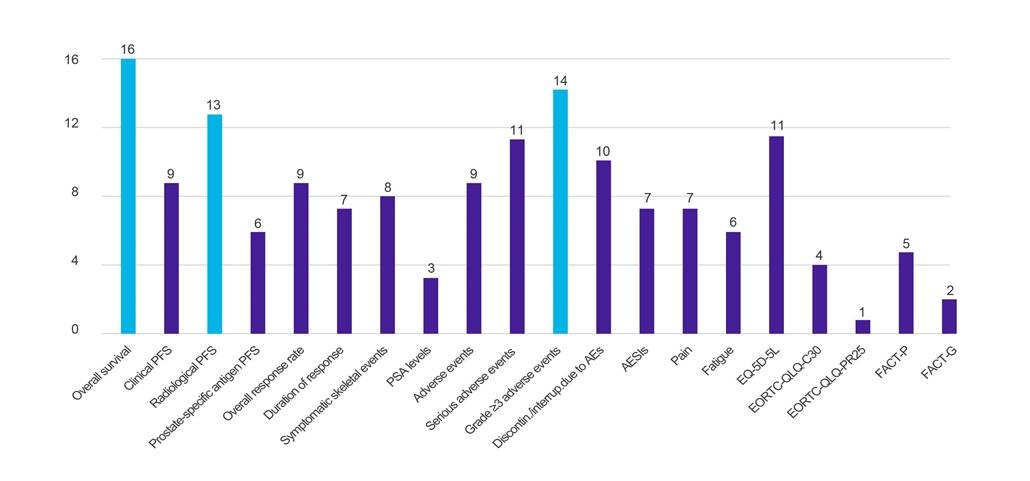
Llave: EA – evento adverso; AESI – evento adverso de especial interés; EORTC-QLQ-C30 – Cuestionario de calidad de vida de la Organización Europea para la Investigación y el Tratamiento del Cáncer (-Core, 30 ítems); EORTC-QLQ-PR25 – Cuestionario de Calidad de Vida de la Organización Europea para la Investigación y el Tratamiento del Cáncer (-Próstata, 25 ítems); EQ-5D-5L – EuroQol-5 Dimension-5 Nivel; FACT-G – Evaluación Funcional de la Terapia del Cáncer-General; FACT-P – Evaluación Funcional de la Terapia del Cáncer de Próstata; PFS – supervivencia libre de progresión; PSA: antígeno prostático específico.
Conclusiones

A menos de dos meses de que la JCA entre en vigor, y con la orientación metodológica aún pendiente, persisten incertidumbres significativas tanto para la industria como para los organismos de HTA con respecto al proceso de determinación del alcance, que constituye la base de la JCA. Los ejercicios PICO organizados por el HTACG y en los que participan varios organismos de ETS, así como las simulaciones de PICO realizadas por los HTD, son cruciales para preparar a las partes interesadas clave para la próxima JCA en términos de capacidad y estrategia interna. Sin embargo, queda por ver cómo se traducirán estas simulaciones en el ACJ real y qué impacto tendrá la evaluación en el acceso a los mercados locales. La ETS de la UE funcionará como un sistema de aprendizaje durante las JCA iniciales, y la colaboración, el esfuerzo y la retroalimentación de todas las partes interesadas serán esenciales para crear un sistema eficiente.
Fuentes
-
EUnetHTA 21. Guía práctica. D4.2 Proceso de determinación del ámbito. Versión 1.0. 2022. Consultado el 23 de septiembre de 2024. https://www.eunethta.eu/wp-content/uploads/2022/09/EUnetHTA-21-D4.2-practical-guideline-on-scoping-process-v1.0.pdf
-
EUnetHTA 21. PICO consolidado. Ejercicio PICO I – Pluvicto. Versión 1.0. 2023. Consultado el 23 de septiembre de 2024. https://www.eunethta.eu/wp-content/uploads/2023/09/EUnetHTA-21-PICO-1-Deliverbale-1.pdf
-
Comisión Europea. Reglamento (CE) 2021/2282 del Parlamento Europeo y del Consejo, de 15 de diciembre de 2021, sobre evaluación de las tecnologías sanitarias y por el que se modifica la Directiva 2011/24/UE. 2021. Consultado el 23 de septiembre de 2024. https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32021R2282
-
Comisión Europea. De la teoría a la práctica: aplicación del Reglamento de la UE sobre la evaluación de las tecnologías sanitarias. 2023. Consultado el 11 de mayo de 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-05-11_en
-
Comisión Europea. De la teoría a la práctica: aplicación del Reglamento de la UE sobre la evaluación de las tecnologías sanitarias. 2023. Consultado el 18 de septiembre de 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-09-18_en
-
Comisión Europea. De la teoría a la práctica: aplicación del Reglamento de la UE sobre la evaluación de las tecnologías sanitarias. 2023. Consultado el 22 de noviembre de 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-11-22_en
-
Comisión Europea. De la teoría a la práctica: aplicación del Reglamento de la UE sobre la evaluación de las tecnologías sanitarias. 2024. Consultado el 30 de enero de 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-01-30_en
-
Comisión Europea. De la teoría a la práctica: aplicación del Reglamento de la UE sobre la evaluación de las tecnologías sanitarias. 2024. Consultado el 9 de abril de 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-04-09_en
-
Comisión Europea. De la teoría a la práctica: aplicación del Reglamento de la UE sobre la evaluación de las tecnologías sanitarias. 2024. Consultado el 23 de septiembre de 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-09-06_en
-
Comisión Europea. Plan renovable de implementación 2023-2024. Actualizado en septiembre de 2024. Consultado el 23 de septiembre de 2024. https://health.ec.europa.eu/document/download/397b2a2e-1793-48fd-b9f5-7b8f0b05c7dd_en
-
Comisión Europea. Evaluación de tecnologías sanitarias: evaluaciones clínicas conjuntas de dispositivos médicos. 2024. Consultado el 5 de noviembre de 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13707-Health-technology-assessment-joint-clinical-assessments-of-medical-devices_en
-
Comisión Europea. Evaluación de tecnologías sanitarias: evaluaciones clínicas conjuntas de medicamentos. 2024. Consultado el 24 de septiembre de 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13708-Health-technology-assessment-joint-clinical-assessments-of-medicinal-products_en
-
Comisión Europea. Evaluación de tecnologías sanitarias: normas de procedimiento para evaluar y gestionar los conflictos de intereses. 2024. Consultado el 23 de septiembre de 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13751-Health-technology-assessment-procedural-rules-for-assessing-and-managing-conflicts-of-interest_en
-
Comisión Europea. Evaluación de tecnologías sanitarias: cooperación con la Agencia Europea de Medicamentos. 2024. Consultado el 23 de septiembre de 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/14164-Health-technology-assessment-cooperation-with-the-European-Medicines-Agency_en
-
Comisión Europea. Evaluación de tecnologías sanitarias: consultas científicas conjuntas sobre dispositivos médicos y dispositivos médicos de diagnóstico in vitro. 2024. Consultado el 5 de noviembre de 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13752-Health-technology-assessment-joint-scientific-consultations-on-medical-devices-in-vitro-diagnostic-medical-devices_en
-
Comisión Europea. Evaluación de tecnologías sanitarias: consultas científicas conjuntas sobre medicamentos de uso humano. 2024. Consultado el 22 de octubre de 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13759-Health-technology-assessment-Joint-scientific-consultations-on-medicinal-products-for-human-use_en
-
Comisión Europea. Evaluación clínica conjunta de medicamentos: presentación de información temprana por parte de los desarrolladores de tecnologías sanitarias. 2024. Consultado el 23 de septiembre de 2024. https://health.ec.europa.eu/document/download/77476507-9ddc-47e3-ae0d-11c05f89169c_en?filename=hta_%20mp-jca_htd_en.pdf
-
Federación Europea de Industrias y Asociaciones Farmacéuticas. Reglamento de la UE sobre HTA para medicamentos oncológicos: Aprendizajes de una simulación sobre el impacto de los métodos EUnetHTA21 propuestos. 2024. Consultado el 23 de septiembre de 2024. https://www.efpia.eu/media/qrjah2ij/efpia-evidera-research-on-eunethta21-methods.pdf
-
Agencia Europea de Medicamentos. Medicamentos de terapia avanzada: Visión general. 2024. Consultado el 23 de septiembre de 2024. https://www.ema.europa.eu/en/human-regulatory-overview/advanced-therapy-medicinal-products-overview
-
HTACG. Especificaciones científicas de los medicamentos sujetos a evaluaciones clínicas conjuntas. 2024. Consultado el 23 de septiembre de 2024. https://health.ec.europa.eu/document/download/48974c78-1c37-4cf9-9fc9-a630fee9baac_en?filename=hta_mp_jca_sc-specifications_en.pdf
-
O'Donnell R. De la ansiedad PICO a la estrategia PICO: planificación para el éxito de la ETS en la UE. 2024. Consultado el 23 de septiembre de 2024. https://www.amerisourcebergen.com/insights/manufacturers/from-pico-anxiety-to-pico-strategy




