Not long until the Joint Clinical Assessment begins: Will PICO anxiety become a reality?

Ben je klaar?
Recente ontwikkelingen
Wetenschappelijke specificaties van geneesmiddelen
Nieuwe werkzame stof |
Een nieuwe chemische, biologische of radiofarmaceutische werkzame stof die:
|
Kankerbehandeling |
|
ATMP |
|
Sleutel: ATMP – geneesmiddel voor geavanceerde therapie; EC – Europese Commissie; EU – Europese Unie; HTACG – Coördinatiegroep voor de evaluatie van gezondheidstechnologie; ICD-O – Internationale classificatie van ziekten voor oncologie; JCA – Gezamenlijke klinische evaluatie.
Uitstaande uitvoeringshandelingen en richtsnoeren
Uitvoeringshandeling |
Termijn |
Status |
|
Procedureregels voor het GCA voor geneesmiddelen |
Q1-Q2 2024 |
Aangenomen op 23 mei 2024 |
|
Regels voor samenwerking door uitwisseling van informatie met het EMA |
3e kwartaal 2024 |
Aangenomen op 18 oktober 2024 |
|
Procedureregels voor de omgang met belangenconflicten |
3e kwartaal 2024 |
Aangenomen op 25 oktober 2024 |
|
Procedureregels voor het GCC voor geneesmiddelen |
3e kwartaal 2024 |
Definitieve versie in voorbereiding, openbare raadpleging afgerond |
|
Procedureregels voor JSC van medische hulpmiddelen en IVD medische hulpmiddelen |
4e kwartaal 2024 |
Openbare raadpleging loopt tot 26 november 2024 |
|
Procedureregels voor JCA van medische hulpmiddelen en IVD medische hulpmiddelen |
4e kwartaal 2024 |
Planmatig |
Sleutel: EMA – Europees Geneesmiddelenbureau; IVD – in vitro diagnostiek; JCA – Gezamenlijke klinische evaluatie; JSC – Gezamenlijk wetenschappelijk overleg.
Bovendien zijn er momenteel meer dan 10 begeleidingsdocumenten in voorbereiding die zouden moeten worden gepubliceerd voordat de JCA van kracht wordt. Belanghebbenden kijken met name reikhalzend uit naar de richtsnoeren waarin de wetenschappelijke methodologie voor het scopingproces wordt beschreven, aangezien deze naar verwachting een aanvulling zal vormen op eerdere voorlopige richtsnoeren van EUnetHTA 21 over de wijze waarop deze "eerste stap" van het JCA-proces, zoals de definitie van de PICO (populatie, interventie, vergelijking, uitkomst) voor het JCA-toepassingsgebied, zal worden uitgevoerd.
Start van het JCA-proces door de ontwikkelaar van gezondheidstechnologie

PICO-definitie
Tabel 3. Vergelijking van PICO-simulaties in mCRPC door EUnetHTA 21 en Cencora
|
|
EUnetHTA 21 |
Cencora |
|
Aanwijzing |
Volwassen patiënten met progressief prostaatspecifiek membraanantigeen (PSMA)-positieve gemetastaseerde castratieresistente prostaatkanker (mCRPC) die zijn behandeld met remming van de androgeenreceptor (AR)-route en op taxaan gebaseerde chemotherapie |
|
|
Aantal betrokken lidstaten |
8 (Landen niet gespecificeerd) |
16 (België, Tsjechië, Denemarken, Finland, Frankrijk, Duitsland, Griekenland, Ierland, Italië, Luxemburg, Nederland, Noorwegen, Polen, Portugal, Spanje en Zweden) |
|
Resultaten (nr.) |
|
|
|
Bevolkingen |
Bevolking met volledige vergunning + 4 subpopulaties |
Bevolking met volledige vergunning + 4 subpopulaties |
|
Interventie |
Pluvicto |
Cenpicomab |
|
Vergelijkers |
6 |
12 |
|
Resultaten |
21 |
20 (zie Figuur 1) |
|
Geconsolideerde PICO's |
6, waarvan 2 voor de bevolking met volledige vergunning |
18, waarvan 9 voor de bevolking met volledige vergunning (zie tabel 4) |
|
Datum PICO-enquête |
Mei 2022 |
mei 2024 |
Sleutel: nee. –getal; PICO – populatie, interventie, vergelijker, uitkomst.
Uit de vergelijking van beide simulaties blijkt dat het opnemen van een breder scala aan lidstaten en het verlengen van de tijdlijn voor de meest recent goedgekeurde vergelijkingsmiddelen kan leiden tot een aanzienlijke toename van het aantal geconsolideerde PICO's dat in aanmerking komt voor het toepassingsgebied van de JCA als gevolg van verschillen in klinische richtsnoeren, behandelingsnormen en snelheid van markttoegang voor nieuwe geneesmiddelen tussen EU-landen.
Vergelijkers
Volgens de praktische richtlijn van EUnetHTA 21 resulteert elke vereiste comparator in de opgenomen landen in een aparte PICO voor de beoordelingsomvang. Op basis van deze praktische richtlijn leidde de analyse van Cencora tot een hoog aantal PICO's voor de volledige bevolking, gedreven door de eis van vijf van de 16 landen (Duitsland, Ierland, Italië, Portugal en Spanje) om alle lokaal relevante vergelijkingsmiddelen op te nemen in de klinische beoordeling, met een bereik van twee vergelijkingsmiddelen in Italië tot zeven referentiepersonen in Portugal. Daarentegen verklaarden drie landen (Tsjechië, Frankrijk en Nederland) dat beoordeling aan de hand van één lokaal relevante referentiepersoon voldoende was, een ander land (Polen) verklaarde dat de relevante referentiepersoon zou worden geselecteerd op basis van het grootste marktaandeel, en vijf landen (België, Denemarken, Finland, Noorwegen en Zweden) benadrukten dat de relevante behandelingsoptie zou afhangen van de positionering van het product (d.w.z. de behandelingslijn) door de HTD. In Luxemburg is de beoordeling gebaseerd op het dossier dat is ingediend in het officiële 'pays de provenance' (d.w.z. land van oorsprong, meestal België). In Griekenland werd slechts één referentiepersoon relevant geacht voor de reikwijdte van de beoordeling. Tabel 4 toont de geïdentificeerde PICO's voor de volledige populatie van cenpicomab.
Voor de EUnetHTA 21-analyse zijn geen landspecifieke vereisten gepubliceerd, die het scopingproces in het kader van de JCA weerspiegelen, waarbij individuele landenantwoorden niet beschikbaar zullen worden gesteld aan HTD's.
|
|
Vergelijkingspunten die voor de volledige populatie van cenpicomab van belang zijn |
Landen die om elke vergelijker vragen |
PICO 1 |
Abirateron + prednison/prednisolon |
BE, DE, FI, FR, IE, LU, NL, NO, PT, SE |
PICO 2 |
Beste ondersteunende zorg* |
DE, DK, ES, FI, IE, NL, NO, SE |
PICO 3 |
Cabazitaxel + prednison/prednisolon* |
BE, DE,DK, ES, FI, IE, IT, LU, NL, NO, PT, SE |
PICO 4 |
Docetaxel + prednison/prednisolon* |
BE, DK, FI, IE,LU, NL, NO, PT, SE |
PICO 5 |
Enzalutamide |
BE, DE,DK, FI, FR, IE, LU, NL, NO, PT, SE |
PICO 6 |
Lutetium (177Lu) vipivotide tetraxetan + androgeendeprivatietherapie* |
BE, DE, FI, GR, IE, IT,NL, PO, PT |
PICO 7 |
Olaparib* |
DK, PT |
PICO 8 |
Radium-223* |
ES, FI, PO |
PICO 9 |
Radium-223 + luteïniserend hormoon afgevend hormoon analoog* |
PO, PT |
Sleutel: BE – België; CZ – Tsjechië; DE – Duitsland; DK – Denemarken; ES – Spanje; FI – Finland; FR – Frankrijk; GR – Griekenland; IE – Ierland; IT – Italië; LU – Luxemburg; NL – Nederland; NEE – Noorwegen; PICO – populatie, interventie, vergelijker, uitkomst; PO – Polen; PT – Portugal; SE – Zweden.
Opmerking: Vetgedrukte landen vertegenwoordigen de landen waarvan de PICO is afgeleid vanwege het verzoek om gegevens van alle geïdentificeerde vergelijkingspunten.
*Vergelijkingspunten die ook in PICO's worden overwogen voor subpopulaties (hier niet weergegeven).
De mogelijkheid van uitgebreide PICO's als gevolg van de scopingfase werd bevestigd in een recente EFPIA-simulatie voor drie goedgekeurde oncologische behandelingen, waaronder weesgeneesmiddelen en ATMP's, wat resulteerde in een groot aantal potentiële PICO's in zeven landen, variërend van zeven tot 23 PICO's na consolidatie.
Resultaten
Figuur 1. Aantal landen dat gegevens heeft opgevraagd op basis van gespecificeerde klinische uitkomsten
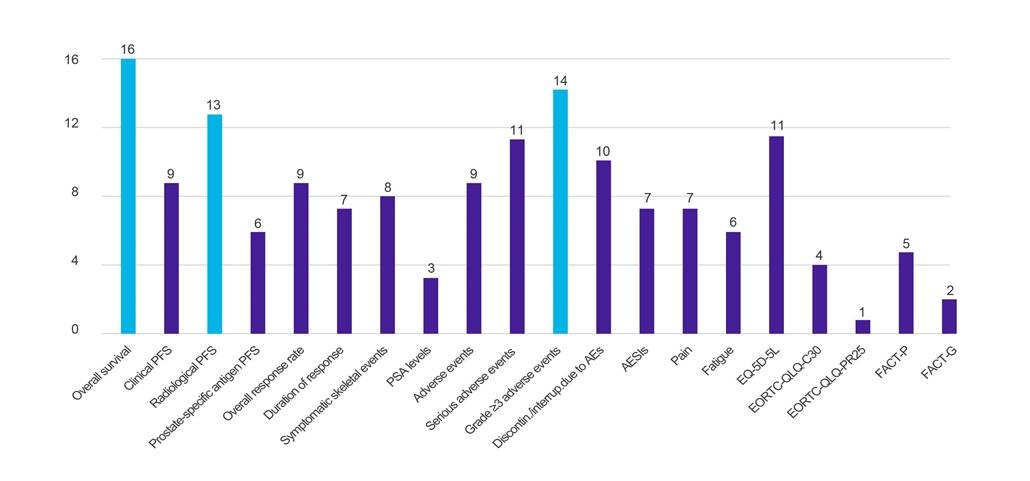
Sleutel: AE – bijwerking; AESI – bijwerking van bijzonder belang; EORTC-QLQ-C30 – Vragenlijst van de Europese Organisatie voor onderzoek en behandeling van de kwaliteit van leven van kanker (-Core, 30 items); EORTC-QLQ-PR25 – Vragenlijst van de Europese organisatie voor onderzoek naar en behandeling van de kwaliteit van leven van kanker (-prostaat, 25 items); EQ-5D-5L – EuroQol-5 dimensie-5-niveau; FEIT-G - Functionele beoordeling van kankertherapie-algemeen; FEIT-P - Functionele beoordeling van kankertherapie-prostaat; PFS – progressievrije overleving; PSA – prostaatspecifiek antigeen.
Conclusies

Met nog minder dan twee maanden te gaan tot de inwerkingtreding van de JCA en met methodologische richtsnoeren die nog in behandeling zijn, blijven er aanzienlijke onzekerheden bestaan voor zowel de industrie als de EGT-instanties met betrekking tot het scopingproces, dat de basis vormt van de JCA. PICO-oefeningen die door de HTACG worden georganiseerd en waarbij verschillende HTA-instanties betrokken zijn, evenals PICO-simulaties die door HTD's worden uitgevoerd, zijn van cruciaal belang om de belangrijkste belanghebbenden voor te bereiden op de komende JCA in termen van capaciteit en interne strategie. Het valt echter nog te bezien hoe deze simulaties zich zullen vertalen in de daadwerkelijke JCA en welke impact de beoordeling zal hebben op de lokale markttoegang. De EGT van de EU zal tijdens de eerste JCA's functioneren als een leersysteem, en de samenwerking, inspanning en feedback van alle belanghebbenden zullen essentieel zijn om een efficiënt systeem te creëren.
Bronnen
-
EUnetHTA 21. Praktische richtlijn. D4.2 Scopingproces. Versie 1.0. 2022. Geraadpleegd op 23 september 2024. https://www.eunethta.eu/wp-content/uploads/2022/09/EUnetHTA-21-D4.2-practical-guideline-on-scoping-process-v1.0.pdf
-
EUnetHTA 21. Geconsolideerde PICO. PICO oefening I – Pluvicto. Versie 1.0. 2023. Geraadpleegd op 23 september 2024. https://www.eunethta.eu/wp-content/uploads/2023/09/EUnetHTA-21-PICO-1-Deliverbale-1.pdf
-
Europese Commissie. Verordening (EG) 2021/2282 van het Europees Parlement en de Raad van 15 december 2021 betreffende de evaluatie van gezondheidstechnologie en tot wijziging van Richtlijn 2011/24/EU. 2021. Geraadpleegd op 23 september 2024. https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32021R2282
-
Europese Commissie. Van theorie naar praktijk: implementatie van de EU-verordening voor de evaluatie van gezondheidstechnologie. 2023. Geraadpleegd op 11 mei 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-05-11_en
-
Europese Commissie. Van theorie naar praktijk: implementatie van de EU-verordening voor de evaluatie van gezondheidstechnologie. 2023. Geraadpleegd op 18 september 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-09-18_en
-
Europese Commissie. Van theorie naar praktijk: implementatie van de EU-verordening voor de evaluatie van gezondheidstechnologie. 2023. Geraadpleegd op 22 november 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-11-22_en
-
Europese Commissie. Van theorie naar praktijk: implementatie van de EU-verordening voor de evaluatie van gezondheidstechnologie. 2024. Geraadpleegd op 30 januari 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-01-30_en
-
Europese Commissie. Van theorie naar praktijk: implementatie van de EU-verordening voor de evaluatie van gezondheidstechnologie. 2024. Geraadpleegd op 9 april 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-04-09_en
-
Europese Commissie. Van theorie naar praktijk: implementatie van de EU-verordening voor de evaluatie van gezondheidstechnologie. 2024. Geraadpleegd op 23 september 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-09-06_en
-
Europese Commissie. Implementatie voortschrijdend plan 2023-2024. Bijgewerkt in september 2024. Geraadpleegd op 23 september 2024. https://health.ec.europa.eu/document/download/397b2a2e-1793-48fd-b9f5-7b8f0b05c7dd_en
-
Europese Commissie. Evaluatie van gezondheidstechnologie – gezamenlijke klinische evaluaties van medische hulpmiddelen. 2024. Geraadpleegd op 5 november 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13707-Health-technology-assessment-joint-clinical-assessments-of-medical-devices_en
-
Europese Commissie. Evaluatie van gezondheidstechnologie – gezamenlijke klinische evaluaties van geneesmiddelen. 2024. Geraadpleegd op 24 september 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13708-Health-technology-assessment-joint-clinical-assessments-of-medicinal-products_en
-
Europese Commissie. Evaluatie van gezondheidstechnologie – procedureregels voor de beoordeling van en het beheer van belangenconflicten. 2024. Geraadpleegd op 23 september 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13751-Health-technology-assessment-procedural-rules-for-assessing-and-managing-conflicts-of-interest_en
-
Europese Commissie. Evaluatie van gezondheidstechnologie – samenwerking met het Europees Geneesmiddelenbureau. 2024. Geraadpleegd op 23 september 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/14164-Health-technology-assessment-cooperation-with-the-European-Medicines-Agency_en
-
Europese Commissie. Evaluatie van gezondheidstechnologie – gezamenlijk wetenschappelijk overleg over medische hulpmiddelen en medische hulpmiddelen voor in-vitrodiagnostiek. 2024. Geraadpleegd op 5 november 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13752-Health-technology-assessment-joint-scientific-consultations-on-medical-devices-in-vitro-diagnostic-medical-devices_en
-
Europese Commissie. Evaluatie van gezondheidstechnologie – gezamenlijk wetenschappelijk overleg over geneesmiddelen voor menselijk gebruik. 2024. Geraadpleegd op 22 oktober 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13759-Health-technology-assessment-Joint-scientific-consultations-on-medicinal-products-for-human-use_en
-
Europese Commissie. Gezamenlijke klinische evaluatie van geneesmiddelen: indiening van vroegtijdige informatie door ontwikkelaars van gezondheidstechnologie. 2024. Geraadpleegd op 23 september 2024. https://health.ec.europa.eu/document/download/77476507-9ddc-47e3-ae0d-11c05f89169c_en?filename=hta_%20mp-jca_htd_en.pdf
-
Europese Federatie van Farmaceutische Industrieën en Verenigingen. EU EGT-verordening voor oncologische geneesmiddelen: Lessen uit een simulatie van de impact van voorgestelde EUnetHTA21-methoden. 2024. Geraadpleegd op 23 september 2024. https://www.efpia.eu/media/qrjah2ij/efpia-evidera-research-on-eunethta21-methods.pdf
-
Europees Geneesmiddelenbureau. Geneesmiddelen voor geavanceerde therapie: Overzicht. 2024. Geraadpleegd op 23 september 2024. https://www.ema.europa.eu/en/human-regulatory-overview/advanced-therapy-medicinal-products-overview
-
HTACG. Wetenschappelijke specificaties van geneesmiddelen die aan gezamenlijke klinische evaluaties worden onderworpen. 2024. Geraadpleegd op 23 september 2024. https://health.ec.europa.eu/document/download/48974c78-1c37-4cf9-9fc9-a630fee9baac_en?filename=hta_mp_jca_sc-specifications_en.pdf
-
O'Donnell R. Van PICO-angst tot PICO-strategie: plannen voor EU-HTA-succes. 2024. Geraadpleegd op 23 september 2024. https://www.amerisourcebergen.com/insights/manufacturers/from-pico-anxiety-to-pico-strategy




