Nu mai e mult până la începerea evaluării clinice comune: Anxietatea PICO va deveni realitate?

Eşti gata?
Evoluții recente
Specificațiile științifice ale medicamentelor
Substanță activă nouă |
O nouă substanță activă chimică, biologică sau radiofarmaceutică care:
|
Tratamentul cancerului |
|
ATMP |
|
Cheie: ATMP – medicament pentru terapie avansată; CE – Comisia Europeană; UE – Uniunea Europeană; HTACG – Grupul de coordonare a evaluării tehnologiilor medicale; ICD-O – Clasificarea internațională a bolilor pentru oncologie; JCA – Evaluare clinică comună.
Actele de punere în aplicare și documentele de orientare restante
Actul de punere în aplicare |
Termenul limită |
Stare |
|
Norme procedurale pentru JCA pentru medicamente |
T1–T2 2024 |
Adoptată la 23 mai 2024 |
|
Norme privind cooperarea prin schimb de informații cu EMA |
Trimestrul 3 2024 |
Adoptată la 18 octombrie 2024 |
|
Norme procedurale pentru gestionarea conflictelor de interese |
Trimestrul 3 2024 |
Adoptat la 25 octombrie 2024 |
|
Norme procedurale pentru CSA de medicamente |
Trimestrul 3 2024 |
Versiunea finală în pregătire, consultare publică închisă |
|
Norme procedurale pentru SA de dispozitive medicale și dispozitive medicale IVD |
T4 2024 |
Consultare publică deschisă până la 26 noiembrie 2024 |
|
Norme procedurale pentru JCA pentru dispozitive medicale și dispozitive medicale IVD |
T4 2024 |
Planificate |
Cheie: EMA – Agenția Europeană pentru Medicamente; IVD – diagnostic in vitro; JCA – Evaluare clinică comună; SA – Consultare științifică comună.
În plus, peste 10 documente de orientare sunt în prezent în pregătire și ar trebui să fie publicate înainte de intrarea în vigoare a JCA. Printre acestea, orientările care descriu metodologia științifică pentru procesul de stabilire a domeniului de aplicare sunt așteptate cu deosebită nerăbdare de părțile interesate, deoarece se așteaptă să completeze orientările preliminare anterioare ale EUnetHTA 21 cu privire la modul în care va fi efectuată această "primă etapă" a procesului JCA, cum ar fi definirea PICO (populație, intervenție, comparator, rezultat) pentru domeniul de aplicare JCA.
Inițierea procesului JCA de către dezvoltatorul tehnologiei medicale

Definiția PICO
Tabelul 3. Compararea simulărilor PICO în mCRPC de către EUnetHTA 21 și Cencora
|
|
EUnetHTA 21 |
Cencora |
|
Semn |
Pacienți adulți cu cancer de prostată metastatic progresiv rezistent la castrare (mCRPC) cu antigen membranar specific prostatic (PSMA) care au fost tratați cu inhibarea căii receptorilor androgeni (AR) și chimioterapie pe bază de taxani |
|
|
Numărul de state membre vizate |
8 (Țări nespecificate) |
16 (Belgia, Republica Cehă, Danemarca, Finlanda, Franța, Germania, Grecia, Irlanda, Italia, Luxemburg, Țările de Jos, Norvegia, Polonia, Portugalia, Spania și Suedia) |
|
Rezultate (nr.) |
|
|
|
Populaţii |
Populație completă licențiată + 4 subpopulații |
Populație completă licențiată + 4 subpopulații |
|
Intervenție |
Pluvicto |
Cenpicomab |
|
Comparatoare |
6 |
12 |
|
Rezultate |
21 |
20 (vezi Figura 1) |
|
PICO consolidate |
6, inclusiv 2 pentru întreaga populație licențiată |
18, inclusiv 9 pentru întreaga populație licențiată (a se vedea tabelul 4) |
|
Data sondajului PICO |
Noiembrie 2022 |
Mai 2024 |
Legendă: nu. –număr; PICO – populație, intervenție, comparator, rezultat.
Comparația ambelor simulări arată că includerea unei game mai largi de state membre și extinderea termenului pentru a captura cei mai recent comparatori aprobați poate duce la o creștere semnificativă a PICO consolidate care trebuie luate în considerare pentru domeniul de aplicare JCA, din cauza variațiilor în ceea ce privește ghidurile clinice, standardele de tratament și viteza de acces pe piață a noilor medicamente în țările UE.
Comparatoare
În conformitate cu orientările practice ale EUnetHTA 21, fiecare comparator necesar între țările incluse are ca rezultat un PICO separat pentru domeniul de aplicare. Urmând acest ghid practic, analiza Cencora a condus la un număr ridicat de PICO pentru întreaga populație, determinat de cerința a cinci dintre cele 16 țări (Germania, Irlanda, Italia, Portugalia și Spania) de a include toți factorii de comparare relevanți la nivel local în evaluarea clinică, acoperind o gamă de doi factori de comparare din Italia și șapte din Portugalia. În schimb, trei țări (Republica Cehă, Franța și Țările de Jos) au declarat că evaluarea în raport cu un element de comparație relevant la nivel local este suficientă, o altă țară (Polonia) a declarat că persoana de comparare relevantă va fi selectată pe baza celei mai mari cote de piață, iar cinci țări (Belgia, Danemarca, Finlanda, Norvegia și Suedia) au subliniat că opțiunea de tratament relevantă va depinde de poziționarea produsului (adică linia de tratament) de către HTD. În Luxemburg, evaluarea se bazează pe dosarul depus în "pays de provenance" oficial (adică țara de origine, de obicei Belgia). În Grecia, un singur element de comparație a fost considerat relevant pentru domeniul de aplicare. Tabelul 4 prezintă PICO identificate pentru întreaga populație de cenpicomab.
Pentru analiza EUnetHTA 21, nu au fost publicate cerințe specifice fiecărei țări, ceea ce reflectă procesul de stabilire a domeniului de aplicare în cadrul JCA, în care răspunsurile individuale ale țărilor nu vor fi puse la dispoziția HTD.
|
|
Comparatori de interes pentru întreaga populație pentru cenpicomab |
Țări care solicită fiecare comparator |
PICO 1 |
Abirateron + prednison/prednisolon |
BE, DE, FI, FR, IE, LU, NL, NO, PT, SE |
PICO 2 |
Cea mai bună îngrijire de susținere* |
DE,DK, ES, FI, IE, NL, NO, SE |
PICO 3 |
Cabazitaxel + prednison/prednisolon* |
BE, DE, DK, ES, FI, IE, IT, LU, NL, NO, PT, SE |
PICO 4 |
Docetaxel + prednison/prednisolon* |
BE, DK, FI, IE, LU, NL, NO, PT, SE |
PICO 5 |
Enzalutamidă |
BE, DE, DK, FI, FR, IE, LU, NL, NO, PT, SE |
PICO 6 |
Lutețiu (177Lu) vipivotidă tetraxetan + terapie de deprivare androgenică* |
BE, DE, FI, GR, IE, IT, NL, PO, PT |
PICO 7 |
Olaparib* |
DK, PT |
PICO 8 |
Radiu-223* |
ES, FI, PO |
PICO 9 |
Radiu-223 + hormon de eliberare a hormonului luteinizant analog* |
PO, PT |
Cheie: BE – Belgia; CZ – Republica Cehă; DE – Germania; DK – Danemarca; ES – Spania; FI – Finlanda; FR – Franța; GR – Grecia; IE – Irlanda; IT – Italia; LU – Luxemburg; NL – Țările de Jos; NU – Norvegia; PICO – populație, intervenție, comparator, rezultat; OP – Polonia; PT – Portugalia; SE – Suedia.
Notă: Țările îngroșate reprezintă țările din care a fost derivat PICO ca urmare a solicitării de date pentru toți comparatorii identificați.
*Comparatori luați în considerare și în PICO-uri pentru subpopulații (nu sunt prezentați aici).
Posibilitatea unor PICO extinse care rezultă din faza de stabilire a domeniului de aplicare a fost confirmată într-o simulare recentă EFPIA pentru trei tratamente oncologice autorizate, inclusiv orfane și ATMP, care a dus la un număr mare de PICO potențiale în șapte țări, variind de la șapte la 23 de PICO după consolidare.
Rezultate
Figura 1. Numărul de țări care solicită date pentru rezultatele clinice specificate
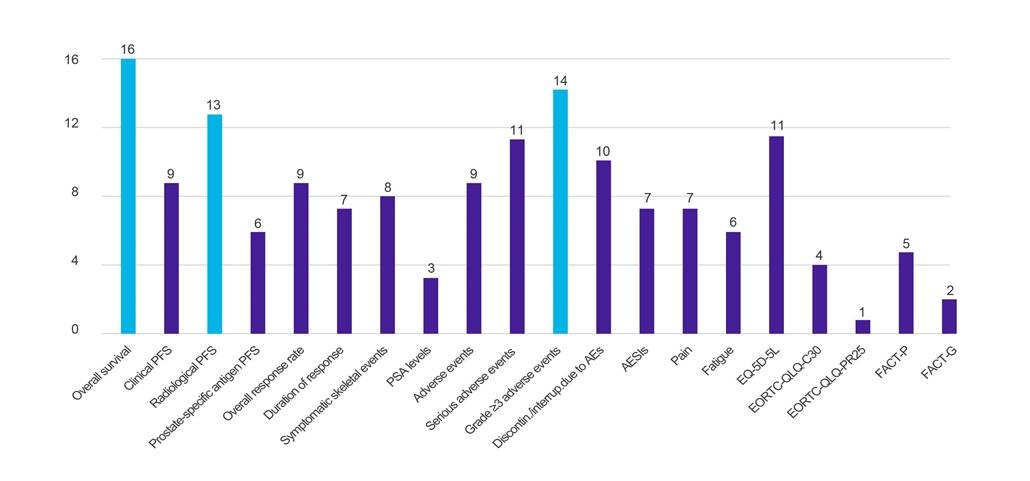
Cheie: AE – eveniment advers; AESI – eveniment advers de interes special; EORTC-QLQ-C30 – Chestionarul privind calitatea vieții al Organizației Europene pentru Cercetare și Tratament al Cancerului (-Core, 30 de itemi); EORTC-QLQ-PR25 – Chestionarul privind calitatea vieții al Organizației Europene pentru Cercetare și Tratament al Cancerului (-Prostată, 25 de itemi); EQ-5D-5L – EuroQol-5 Dimensiune-5 Nivel; FACT-G – Evaluarea funcțională a terapiei cancerului-general; FACT-P – Evaluarea funcțională a terapiei cancerului-prostată; PFS – supraviețuire fără progresie; PSA – antigen specific prostatei.
Concluziile

Cu mai puțin de două luni rămase până la intrarea în vigoare a JCA și cu îndrumări metodologice încă în așteptare, persistă incertitudini semnificative atât pentru industrie, cât și pentru organismele HTA cu privire la procesul de stabilire a domeniului de aplicare, care stă la baza JCA. Exercițiile PICO organizate de HTACG și care implică diverse organisme de HTA, precum și simulările PICO efectuate de HTD, sunt cruciale pentru pregătirea părților interesate cheie pentru viitorul JCA în ceea ce privește capacitatea și strategia internă. Cu toate acestea, rămâne de văzut cum se vor traduce aceste simulări în JCA real și ce impact va avea evaluarea asupra accesului pe piața locală. ETM a UE va funcționa ca un sistem de învățare în timpul JCA inițiale, iar colaborarea, efortul și feedbackul tuturor părților interesate vor fi esențiale pentru crearea unui sistem eficient.
Surse
-
EUnetHTA 21. Ghid practic. D4.2 Procesul de stabilire a domeniului de aplicare. Versiunea 1.0. 2022. Accesat la 23 septembrie 2024. https://www.eunethta.eu/wp-content/uploads/2022/09/EUnetHTA-21-D4.2-practical-guideline-on-scoping-process-v1.0.pdf
-
EUnetHTA 21. PICO consolidat. Exercițiul PICO I – Pluvicto. Versiunea 1.0. 2023. Accesat la 23 septembrie 2024. https://www.eunethta.eu/wp-content/uploads/2023/09/EUnetHTA-21-PICO-1-Deliverbale-1.pdf
-
Comisia Europeană. Regulamentul (CE) 2021/2282 al Parlamentului European și al Consiliului din 15 decembrie 2021 privind evaluarea tehnologiilor medicale și de modificare a Directivei 2011/24/UE. 2021. Accesat la 23 septembrie 2024. https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32021R2282
-
Comisia Europeană. De la teorie la practică: punerea în aplicare a Regulamentului UE privind evaluarea tehnologiilor medicale. 2023. Accesat la 11 mai 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-05-11_en
-
Comisia Europeană. De la teorie la practică: punerea în aplicare a Regulamentului UE privind evaluarea tehnologiilor medicale. 2023. Accesat la 18 septembrie 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-09-18_en
-
Comisia Europeană. De la teorie la practică: punerea în aplicare a Regulamentului UE privind evaluarea tehnologiilor medicale. 2023. Accesat la 22 noiembrie 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-11-22_en
-
Comisia Europeană. De la teorie la practică: punerea în aplicare a Regulamentului UE privind evaluarea tehnologiilor medicale. 2024. Accesat la 30 ianuarie 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-01-30_en
-
Comisia Europeană. De la teorie la practică: punerea în aplicare a Regulamentului UE privind evaluarea tehnologiilor medicale. 2024. Accesat la 9 aprilie 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-04-09_en
-
Comisia Europeană. De la teorie la practică: punerea în aplicare a Regulamentului UE privind evaluarea tehnologiilor medicale. 2024. Accesat la 23 septembrie 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-09-06_en
-
Comisia Europeană. Plan continuu de implementare 2023-2024. Actualizat în septembrie 2024. Accesat la 23 septembrie 2024. https://health.ec.europa.eu/document/download/397b2a2e-1793-48fd-b9f5-7b8f0b05c7dd_en
-
Comisia Europeană. Evaluarea tehnologiilor medicale – evaluări clinice comune ale dispozitivelor medicale. 2024. Accesat la 5 noiembrie 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13707-Health-technology-assessment-joint-clinical-assessments-of-medical-devices_en
-
Comisia Europeană. Evaluarea tehnologiilor medicale – evaluări clinice comune ale medicamentelor. 2024. Accesat la 24 septembrie 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13708-Health-technology-assessment-joint-clinical-assessments-of-medicinal-products_en
-
Comisia Europeană. Evaluarea tehnologiilor medicale – reguli procedurale pentru evaluarea și gestionarea conflictelor de interese. 2024. Accesat la 23 septembrie 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13751-Health-technology-assessment-procedural-rules-for-assessing-and-managing-conflicts-of-interest_en
-
Comisia Europeană. Evaluarea tehnologiilor medicale – cooperare cu Agenția Europeană pentru Medicamente. 2024. Accesat la 23 septembrie 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/14164-Health-technology-assessment-cooperation-with-the-European-Medicines-Agency_en
-
Comisia Europeană. Evaluarea tehnologiei medicale – consultații științifice comune privind dispozitivele medicale și dispozitivele medicale pentru diagnostic in vitro. 2024. Accesat la 5 noiembrie 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13752-Health-technology-assessment-joint-scientific-consultations-on-medical-devices-in-vitro-diagnostic-medical-devices_en
-
Comisia Europeană. Evaluarea tehnologiilor medicale – consultări științifice comune privind medicamentele de uz uman. 2024. Accesat la 22 octombrie 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13759-Health-technology-assessment-Joint-scientific-consultations-on-medicinal-products-for-human-use_en
-
Comisia Europeană. Evaluarea clinică comună a medicamentelor: transmiterea de informații timpurii de către dezvoltatorii de tehnologii medicale. 2024. Accesat la 23 septembrie 2024. https://health.ec.europa.eu/document/download/77476507-9ddc-47e3-ae0d-11c05f89169c_en?filename=hta_%20mp-jca_htd_en.pdf
-
Federația Europeană a Industriilor și Asociațiilor Farmaceutice. Regulamentul UE privind ETM pentru medicamentele oncologice: Învățăminte dintr-o simulare privind impactul metodelor propuse de EUnetHTA21. 2024. Accesat la 23 septembrie 2024. https://www.efpia.eu/media/qrjah2ij/efpia-evidera-research-on-eunethta21-methods.pdf
-
Agenția Europeană pentru Medicamente. Medicamente pentru terapie avansată: Prezentare generală. 2024. Accesat la 23 septembrie 2024. https://www.ema.europa.eu/en/human-regulatory-overview/advanced-therapy-medicinal-products-overview
-
HTACG. Specificațiile științifice ale medicamentelor care fac obiectul evaluărilor clinice comune. 2024. Accesat la 23 septembrie 2024. https://health.ec.europa.eu/document/download/48974c78-1c37-4cf9-9fc9-a630fee9baac_en?filename=hta_mp_jca_sc-specifications_en.pdf
-
O'Donnell R. De la anxietatea PICO la strategia PICO: planificarea succesului ETM în UE. 2024. Accesat la 23 septembrie 2024. https://www.amerisourcebergen.com/insights/manufacturers/from-pico-anxiety-to-pico-strategy




