Nicht mehr lange bis zum Beginn des Joint Clinical Assessments: Wird die PICO-Angst Realität werden?

Bist du so weit?
Jüngste Entwicklungen
Wissenschaftliche Spezifikationen von Arzneimitteln
Neuer Wirkstoff |
Ein neuer chemischer, biologischer oder radiopharmazeutischer Wirkstoff, der:
|
Krebsbehandlung |
|
ATMP |
|
Schlüssel: ATMP – Arzneimittel für neuartige Therapien; EG – Europäische Kommission; EU – Europäische Union; HTACG – Koordinierungsgruppe für die Bewertung von Gesundheitstechnologien; ICD-O – Internationale Klassifikation der Krankheiten für die Onkologie; JCA – Gemeinsame klinische Bewertung.
Noch ausstehende Durchführungsrechtsakte und Leitfäden
Durchführungsrechtsakt |
Stichtag |
Status |
|
Verfahrensvorschriften für JCA von Arzneimitteln |
Q1–Q2 2024 |
Angenommen am 23. Mai 2024 |
|
Regeln für die Zusammenarbeit durch Informationsaustausch mit der EMA |
3. Quartal 2024 |
Angenommen am 18. Oktober 2024 |
|
Verfahrensregeln für den Umgang mit Interessenkonflikten |
3. Quartal 2024 |
Angenommen am 25. Oktober 2024 |
|
Verfahrensvorschriften für die JSC von Arzneimitteln |
3. Quartal 2024 |
Endgültige Fassung in Vorbereitung, öffentliche Konsultation abgeschlossen |
|
Verfahrensvorschriften für JSC von Medizinprodukten und IVD-Medizinprodukten |
4. Quartal 2024 |
Öffentliche Konsultation bis zum 26. November 2024 |
|
Verfahrensvorschriften für JCA von Medizinprodukten und IVD-Medizinprodukten |
4. Quartal 2024 |
Geplant |
Schlüssel: EMA – Europäische Arzneimittel-Agentur; IVD – In-vitro-Diagnostik; JCA – Gemeinsame klinische Bewertung; JSC – Gemeinsame wissenschaftliche Konsultation.
Darüber hinaus sind derzeit mehr als 10 Leitfäden in Vorbereitung, die noch vor Inkrafttreten des JCA veröffentlicht werden sollen. Unter diesen wird der Leitfaden, in dem die wissenschaftliche Methodik für den Scoping-Prozess beschrieben wird, von den Interessenträgern besonders sehnsüchtig erwartet, da er voraussichtlich die früheren vorläufigen Leitlinien von EUnetHTA 21 zur Durchführung dieses "ersten Schritts" des JCA-Prozesses, wie z. B. die Definition des PICO (Population, Intervention, Comparator, Outcome) für den JCA-Geltungsbereich, ergänzen wird.
Initiierung des JCA-Prozesses durch den Health-Technology-Entwickler

PICO-Definition
Tabelle 3. Vergleich von PICO-Simulationen in mCRPC von EUnetHTA 21 und Cencora
|
|
EUnetHTA 21 |
Cencora |
|
Indikation |
Erwachsene Patienten mit progressivem prostataspezifischem Membranantigen (PSMA)-positivem metastasiertem kastrationsresistentem Prostatakrebs (mCRPC), die mit einer Hemmung des Androgenrezeptor (AR)-Signalwegs und einer taxanbasierten Chemotherapie behandelt wurden |
|
|
Anzahl der erfassten Mitgliedstaaten |
8 (Länder nicht angegeben) |
16 (Belgien, Tschechische Republik, Dänemark, Finnland, Frankreich, Deutschland, Griechenland, Irland, Italien, Luxemburg, Niederlande, Norwegen, Polen, Portugal, Spanien und Schweden) |
|
Ergebnisse (Nr.) |
|
|
|
Bevölkerung |
Vollständig lizenzierte Population + 4 Subpopulationen |
Vollständig lizenzierte Population + 4 Subpopulationen |
|
Eingriff |
Pluvicto |
Cenpicomab |
|
Komparatoren |
6 |
12 |
|
Ergebnisse |
21 |
20 (siehe Abbildung 1) |
|
Konsolidierte PICOs |
6, davon 2 für die gesamte lizenzierte Bevölkerung |
18, davon 9 für die gesamte lizenzierte Bevölkerung (siehe Tabelle 4) |
|
Datum der PICO-Erhebung |
November 2022 |
Mai 2024 |
Schlüssel: nein. –Zahl; PICO – Population, Intervention, Komparator, Ergebnis.
Der Vergleich beider Simulationen zeigt, dass die Einbeziehung eines breiteren Spektrums von Mitgliedstaaten und die Verlängerung des Zeitrahmens für die Erfassung der zuletzt zugelassenen Vergleichspräparate aufgrund von Unterschieden bei den klinischen Leitlinien, Behandlungsstandards und der Geschwindigkeit des Marktzugangs neuer Arzneimittel in den EU-Ländern zu einem erheblichen Anstieg der konsolidierten PICOs führen kann, die für den JCA-Geltungsbereich in Betracht gezogen werden müssen.
Komparatoren
Gemäß dem Praxisleitfaden von EUnetHTA 21 führt jeder erforderliche Komparator über die eingeschlossenen Länder hinweg zu einem separaten PICO für den Bewertungsumfang. In Anlehnung an diese praktische Leitlinie führte die Analyse von Cencora zu einer hohen Anzahl von PICOs für die gesamte Bevölkerung, was auf die Anforderung von fünf der 16 Länder (Deutschland, Irland, Italien, Portugal und Spanien) zurückzuführen ist, alle lokal relevanten Komparatoren in die klinische Bewertung einzubeziehen, wobei eine Spanne von zwei Vergleichspräparaten in Italien bis sieben Vergleichspersonen in Portugal abgedeckt wurde. Im Gegensatz dazu erklärten drei Länder (Tschechische Republik, Frankreich und die Niederlande), dass die Bewertung anhand eines lokal relevanten Vergleichspräparats ausreichend sei, ein anderes Land (Polen) erklärte, dass der relevante Vergleichsanbieter auf der Grundlage des höchsten Marktanteils ausgewählt werde, und fünf Länder (Belgien, Dänemark, Finnland, Norwegen und Schweden) betonten, dass die relevante Behandlungsoption von der Positionierung des Produkts (d. h. der Behandlungslinie) durch die HTD abhänge. In Luxemburg stützt sich die Bewertung auf die Unterlagen, die im offiziellen "pays de provenance" (d. h. Ursprungsland, in der Regel Belgien) eingereicht werden. In Griechenland wurde nur ein Vergleichsobjekt als relevant für den Bewertungsumfang angesehen. Tabelle 4 zeigt die identifizierten PICOs für die gesamte Cenpicomab-Population.
Für die EUnetHTA 21-Analyse wurden keine länderspezifischen Anforderungen veröffentlicht, die den Scoping-Prozess im Rahmen des JCA widerspiegeln, bei dem den einzelnen Länderantworten den HTDs nicht zur Verfügung gestellt werden.
|
|
Vergleichsdaten von Interesse für die Gesamtbevölkerung von Cenpicomab |
Länder, die einen einzelnen Vergleichswert beantragen |
PICO 1 |
Abirateron + Prednison/Prednisolon |
BE, DE, FI, FR, IE, LU, NL, NO, PT, SE |
PICO 2 |
Beste unterstützende Versorgung* |
DE,DK, ES, FI, IE, NL, NO, SE |
PICO 3 |
Cabazitaxel + Prednison/Prednisolon* |
BE, DE,DK, ES, FI, IE, IT, LU, NL, NO, PT, SE |
PICO 4 |
Docetaxel + Prednison/Prednisolon* |
BE, DK, FI, IE, LU, NL, NO, PT, SE |
PICO 5 |
Enzalutamid |
BE, DE,DK, FI, FR, IE, LU, NL, NO, PT, SE |
PICO 6 |
Lutetium (177Lu) Vipivotid Tetraxetan + Androgenentzugstherapie* |
BE, DE,FI, GR, IE, IT, NL, PO, PT |
PICO 7 |
Olaparib* |
DK, PT |
PICO 8 |
Radium-223* |
ES, FI, PO |
PICO 9 |
Radium-223 + luteinisierendes Hormon-Releasing-Hormon-Analogon* |
PO, PT |
Schlüssel: BE – Belgien; CZ – Tschechische Republik; DE – Deutschland; DK – Dänemark; ES – Spanien; FI – Finnland; FR – Frankreich; GR – Griechenland; IE – Irland; IT – Italien; LU – Luxemburg; NL – Niederlande; NEIN – Norwegen; PICO – Population, Intervention, Komparator, Ergebnis; PO – Polen; PT – Portugal; SE – Schweden.
Hinweis: Die fett gedruckten Länder stellen die Länder dar, aus denen der PICO aufgrund der Datenanfrage für alle identifizierten Vergleichspersonen abgeleitet wurde.
*Komparatoren, die auch in PICOs für Subpopulationen berücksichtigt werden (hier nicht dargestellt).
Die Möglichkeit umfangreicher PICOs, die sich aus der Scoping-Phase ergeben, wurde in einer kürzlich durchgeführten EFPIA-Simulation für drei zugelassene onkologische Behandlungen, einschließlich Orphan und ATMP, bestätigt, was zu einer großen Anzahl potenzieller PICOs in sieben Ländern führte, die nach der Konsolidierung zwischen sieben und 23 PICOs lagen.
Ergebnisse
Abbildung 1. Anzahl der Länder, die Daten zu bestimmten klinischen Endpunkten anfordern
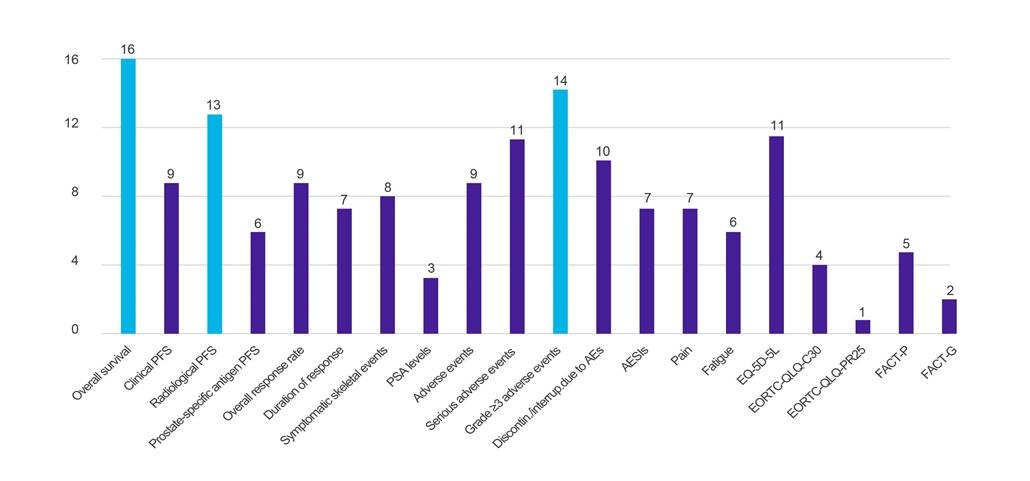
Schlüssel: AE – unerwünschtes Ereignis; AESI – unerwünschtes Ereignis von besonderem Interesse; EORTC-QLQ-C30 – Fragebogen zur Lebensqualität der Europäischen Organisation für Krebsforschung und -behandlung (Kern, 30 Punkte); EORTC-QLQ-PR25 – Fragebogen zur Lebensqualität der Europäischen Organisation für die Erforschung und Behandlung von Krebserkrankungen (-Prostata, 25 Punkte); EQ-5D-5L – EuroQol-5 Dimension-5 Stufe; FACT-G – Funktionelle Bewertung der Krebstherapie – allgemein; FACT-P – Funktionelle Bewertung der Krebstherapie-Prostata; PFS – progressionsfreies Überleben; PSA – prostataspezifisches Antigen.
Schlüsse

Da weniger als zwei Monate bis zum Inkrafttreten des JCA verbleiben und die methodischen Leitlinien noch ausstehen, bestehen sowohl für die Branche als auch für die HTA-Gremien erhebliche Unsicherheiten in Bezug auf den Scoping-Prozess, der die Grundlage des JCA bildet. PICO-Übungen, die von der HTACG organisiert werden und an denen verschiedene HTA-Gremien beteiligt sind, sowie PICO-Simulationen, die von HTDs durchgeführt werden, sind von entscheidender Bedeutung für die Vorbereitung der wichtigsten Interessengruppen auf die bevorstehende JCA in Bezug auf Fähigkeiten und interne Strategie. Es bleibt jedoch abzuwarten, wie sich diese Simulationen in der tatsächlichen JCA niederschlagen werden und welche Auswirkungen die Bewertung auf den lokalen Marktzugang haben wird. Die EU-HTA wird während der ersten JCAs als lernendes System fungieren, und die Zusammenarbeit, die Bemühungen und das Feedback aller Interessengruppen werden für die Schaffung eines effizienten Systems von entscheidender Bedeutung sein.
Quellen
-
EUnetHTA 21. Praktischer Leitfaden. D4.2 Scoping-Prozess. Version 1.0. 2022. Abgerufen am 23. September 2024. https://www.eunethta.eu/wp-content/uploads/2022/09/EUnetHTA-21-D4.2-practical-guideline-on-scoping-process-v1.0.pdf
-
EUnetHTA 21. Konsolidierte PICO. PICO-Übung I – Pluvicto. Version 1.0. 2023. Abgerufen am 23. September 2024. https://www.eunethta.eu/wp-content/uploads/2023/09/EUnetHTA-21-PICO-1-Deliverbale-1.pdf
-
Europäische Kommission. Verordnung (EG) 2021/2282 des Europäischen Parlaments und des Rates vom 15. Dezember 2021 über die Bewertung von Gesundheitstechnologien und zur Änderung der Richtlinie 2011/24/EU. 2021. Abgerufen am 23. September 2024. https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32021R2282
-
Europäische Kommission. Von der Theorie in die Praxis: Umsetzung der EU-Verordnung über die Bewertung von Gesundheitstechnologien. 2023. Abgerufen am 11. Mai 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-05-11_en
-
Europäische Kommission. Von der Theorie in die Praxis: Umsetzung der EU-Verordnung über die Bewertung von Gesundheitstechnologien. 2023. Abgerufen am 18. September 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-09-18_en
-
Europäische Kommission. Von der Theorie in die Praxis: Umsetzung der EU-Verordnung über die Bewertung von Gesundheitstechnologien. 2023. Abgerufen am 22. November 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-11-22_en
-
Europäische Kommission. Von der Theorie in die Praxis: Umsetzung der EU-Verordnung über die Bewertung von Gesundheitstechnologien. 2024. Abgerufen am 30. Januar 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-01-30_en
-
Europäische Kommission. Von der Theorie in die Praxis: Umsetzung der EU-Verordnung über die Bewertung von Gesundheitstechnologien. 2024. Abgerufen am 9. April 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-04-09_en
-
Europäische Kommission. Von der Theorie in die Praxis: Umsetzung der EU-Verordnung über die Bewertung von Gesundheitstechnologien. 2024. Abgerufen am 23. September 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-09-06_en
-
Europäische Kommission. Fortlaufender Umsetzungsplan 2023-2024. Aktualisiert im September 2024. Abgerufen am 23. September 2024. https://health.ec.europa.eu/document/download/397b2a2e-1793-48fd-b9f5-7b8f0b05c7dd_en
-
Europäische Kommission. Health Technology Assessment – gemeinsame klinische Bewertungen von Medizinprodukten. 2024. Abgerufen am 5. November 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13707-Health-technology-assessment-joint-clinical-assessments-of-medical-devices_en
-
Europäische Kommission. Health Technology Assessment – gemeinsame klinische Bewertungen von Arzneimitteln. 2024. Abgerufen am 24. September 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13708-Health-technology-assessment-joint-clinical-assessments-of-medicinal-products_en
-
Europäische Kommission. Bewertung von Gesundheitstechnologien – Verfahrensregeln für die Bewertung und den Umgang mit Interessenkonflikten. 2024. Abgerufen am 23. September 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13751-Health-technology-assessment-procedural-rules-for-assessing-and-managing-conflicts-of-interest_en
-
Europäische Kommission. Bewertung von Gesundheitstechnologien – Zusammenarbeit mit der Europäischen Arzneimittel-Agentur. 2024. Abgerufen am 23. September 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/14164-Health-technology-assessment-cooperation-with-the-European-Medicines-Agency_en
-
Europäische Kommission. Bewertung von Gesundheitstechnologien – gemeinsame wissenschaftliche Konsultationen zu Medizinprodukten und In-vitro-Diagnostika. 2024. Abgerufen am 5. November 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13752-Health-technology-assessment-joint-scientific-consultations-on-medical-devices-in-vitro-diagnostic-medical-devices_en
-
Europäische Kommission. Bewertung von Gesundheitstechnologien – gemeinsame wissenschaftliche Konsultationen zu Humanarzneimitteln. 2024. Abgerufen am 22. Oktober 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13759-Health-technology-assessment-Joint-scientific-consultations-on-medicinal-products-for-human-use_en
-
Europäische Kommission. Gemeinsame klinische Bewertung von Arzneimitteln: Vorlage frühzeitiger Informationen durch Entwickler von Gesundheitstechnologien. 2024. Abgerufen am 23. September 2024. https://health.ec.europa.eu/document/download/77476507-9ddc-47e3-ae0d-11c05f89169c_en?filename=hta_%20mp-jca_htd_en.pdf
-
Europäischer Verband der pharmazeutischen Industrie und Verbände. EU-HTA-Verordnung für onkologische Arzneimittel: Erkenntnisse aus einer Simulation über die Auswirkungen vorgeschlagener EUnetHTA21-Methoden. 2024. Abgerufen am 23. September 2024. https://www.efpia.eu/media/qrjah2ij/efpia-evidera-research-on-eunethta21-methods.pdf
-
Europäischen Arzneimittel-Agentur. Arzneimittel für neuartige Therapien: Überblick. 2024. Abgerufen am 23. September 2024. https://www.ema.europa.eu/en/human-regulatory-overview/advanced-therapy-medicinal-products-overview
-
HTACG. Wissenschaftliche Spezifikationen von Arzneimitteln, die einer gemeinsamen klinischen Bewertung unterzogen werden. 2024. Abgerufen am 23. September 2024. https://health.ec.europa.eu/document/download/48974c78-1c37-4cf9-9fc9-a630fee9baac_en?filename=hta_mp_jca_sc-specifications_en.pdf
-
O'Donnell R. Von der PICO-Angst zur PICO-Strategie: Planung für den Erfolg von EU-HTA. 2024. Abgerufen am 23. September 2024. https://www.amerisourcebergen.com/insights/manufacturers/from-pico-anxiety-to-pico-strategy




