Il ne reste pas longtemps avant le début de l’évaluation clinique conjointe : L’anxiété PICO deviendra-t-elle une réalité ?

Es-tu prêt?
Développements récents
Spécifications scientifiques des médicaments
Nouvelle substance active |
Nouvelle substance active chimique, biologique ou radiopharmaceutique qui :
|
Traitement du cancer |
|
ATMP (en anglais seulement) |
|
Légende : ATMP – médicament de thérapie innovante ; CE – Commission européenne ; UE – Union européenne ; HTACG – Groupe de coordination de l’évaluation des technologies de la santé ; CIM-O – Classification internationale des maladies pour l’oncologie ; JCA – Évaluation clinique conjointe.
Actes d’exécution et documents d’orientation en suspens
Acte d’exécution |
Date limite |
Statut |
|
Règles de procédure pour les JCA des médicaments |
T1 à T2 2024 |
Adopté le 23 mai 2024 |
|
Règles relatives à la coopération par échange d’informations avec l’EMA |
T3 2024 |
Adopté le 18 octobre 2024 |
|
Règles de procédure pour la gestion des conflits d’intérêts |
T3 2024 |
Adopté le 25 octobre 2024 |
|
Règles de procédure applicables à la JSC des médicaments |
T3 2024 |
Version finale en préparation, consultation publique clôturée |
|
Règles de procédure pour les JSC de dispositifs médicaux et de dispositifs médicaux de diagnostic in vitro |
4e trimestre 2024 |
Consultation publique ouverte jusqu’au 26 novembre 2024 |
|
Règles de procédure pour les JCA des dispositifs médicaux et des dispositifs médicaux de diagnostic in vitro |
4e trimestre 2024 |
Planifié |
Légende : EMA – Agence européenne des médicaments ; DIV – diagnostic in vitro ; JCA – Évaluation clinique conjointe ; JSC – Consultation scientifique conjointe.
En outre, plus de 10 documents d’orientation sont actuellement en préparation et devraient être publiés avant l’entrée en vigueur de la JCA. Parmi celles-ci, les orientations décrivant la méthodologie scientifique du processus de détermination de la portée sont particulièrement attendues par les parties prenantes, car elles devraient compléter les précédentes orientations préliminaires d’EUnetHTA 21 sur la manière dont cette « première étape » du processus d’ACM, telle que la définition du PICO (population, intervention, comparateur, résultat) pour le champ d’application de l’ACM, sera menée.
Lancement du processus JCA par le développeur de technologies de la santé

Définition de PICO
Tableau 3. Comparaison des simulations PICO dans mCRPC par EUnetHTA 21 et Cencora
|
|
EUnetHTA 21 |
Cencora (en anglais seulement) |
|
L’indication |
Patients adultes atteints d’un cancer de la prostate métastatique résistant à la castration (mCRPC) positif à l’antigène membranaire spécifique de la prostate (PSMA) positif qui ont été traités par inhibition de la voie des récepteurs aux androgènes (RA) et chimiothérapie à base de taxane |
|
|
Nombre d’États membres couverts |
8 (Pays non précisés) |
16 (Belgique, République tchèque, Danemark, Finlande, France, Allemagne, Grèce, Irlande, Italie, Luxembourg, Pays-Bas, Norvège, Pologne, Portugal, Espagne et Suède) |
|
Résultats (nb.) |
|
|
|
Populations |
Population titulaire d’une licence complète + 4 sous-populations |
Population titulaire d’une licence complète + 4 sous-populations |
|
L’intervention |
Pluvicto |
Le cenpicomab |
|
Comparateurs |
6 |
12 |
|
Résultats |
21 |
20 (voir Graphique 1) |
|
PICO consolidés |
6, dont 2 pour l’ensemble de la population autorisée |
18, dont 9 pour l’ensemble de la population autorisée (voir le tableau 4) |
|
Date de l’enquête PICO |
Novembre 2022 |
mai 2024 |
Clé : non. – le nombre ; PICO – population, intervention, comparateur, résultat.
La comparaison des deux simulations montre que l’inclusion d’un plus large éventail d’États membres et l’allongement du calendrier de prise en compte des comparateurs les plus récemment approuvés peuvent conduire à une augmentation significative des PICO consolidés à prendre en compte pour le champ d’application de la JCA en raison des variations dans les lignes directrices cliniques, les normes de traitement et la rapidité d’accès au marché des nouveaux médicaments dans les pays de l’UE.
Comparateurs
Selon la directive pratique d’EUnetHTA 21, chaque comparateur requis dans les pays inclus donne lieu à un PICO distinct pour le champ d’application de l’évaluation. Suivant cette ligne directrice pratique, l’analyse de Cencora a conduit à un nombre élevé de PICO pour l’ensemble de la population, en raison de l’exigence de cinq des 16 pays (Allemagne, Irlande, Italie, Portugal et Espagne) d’inclure tous les comparateurs localement pertinents dans l’évaluation clinique, couvrant une gamme de deux comparateurs en Italie à sept comparateurs au Portugal. En revanche, trois pays (la République tchèque, la France et les Pays-Bas) ont déclaré que l’évaluation par rapport à un comparateur pertinent au niveau local était suffisante, un autre pays (Pologne) a déclaré que le comparateur pertinent serait sélectionné en fonction de la part de marché la plus élevée, et cinq pays (Belgique, Danemark, Finlande, Norvège et Suède) ont souligné que l’option de traitement pertinente dépendrait du positionnement du produit (c’est-à-dire de la ligne de traitement) par le HTD. Au Luxembourg, l’évaluation se fait sur la base du dossier déposé dans le pays de provenance officiel (c’est-à-dire le pays d’origine, généralement la Belgique). En Grèce, un seul comparateur a été considéré comme pertinent pour le champ d’application de l’évaluation. Le tableau 4 présente les PICO identifiés pour l’ensemble de la population de cenpicomab.
En ce qui concerne l’analyse EUnetHTA 21, les exigences spécifiques à chaque pays n’ont pas été publiées, ce qui reflète le processus de définition de la portée dans le cadre de la JCA, où les réponses individuelles des pays ne seront pas mises à la disposition des DTC.
|
|
Comparateurs d’intérêt pour l’ensemble de la population pour le cenpicomab |
Pays demandant chaque comparateur |
PICO 1 |
Abiratérone + prednisone/prednisolone |
BE, DE, FI, FR, IE, LU, NL, NO, PT, SE |
PICO 2 |
Meilleurs soins de soutien* |
DE,DK, ES, FI, IE, NL, NO, SE |
PICO 3 |
Cabazitaxel + prednisone/prednisolone* |
BE, DE,DK, ES, FI, IE, IT, LU, NL, NO, PT, SE |
PICO 4 |
Docétaxel + prednisone/prednisolone* |
BE, DK, FI, IE,LU, NL, NO, PT, SE |
PICO 5 |
L’enzalutamide |
BE, DE, DK, FI, FR, IE, LU, NL, NO, PT, SE |
PICO 6 |
Lutécium (177Lu) vipivotide tétraxétane + traitement de privation d’androgènes* |
BE, DE, FI, GR, IE, IT,NL, PO, PT |
PICO 7 |
Olaparib* |
DK, PT |
PICO 8 |
Radium-223* |
ES, FI, PO |
PICO 9 |
Radium-223 + analogue de l’hormone de libération de l’hormone lutéinisante* |
PO, PT |
Légende : BE – Belgique ; CZ – République tchèque ; DE – Allemagne ; DK – Danemark ; ES – Espagne ; FI – Finlande ; FR – France ; GR – Grèce ; IE – Irlande ; IT – Italie ; LU – Luxembourg ; NL – Pays-Bas ; NON – Norvège ; PICO – population, intervention, comparateur, résultat ; PO – Pologne ; PT – Portugal ; SE – Suède.
Remarque : Les pays en gras représentent les pays d’où provient le CIPC en raison de la demande de données par rapport à tous les comparateurs identifiés.
*Les comparateurs sont également pris en compte dans les PICO pour les sous-populations (non présentés ici).
La possibilité de PICO étendus résultant de la phase de cadrage a été confirmée dans une simulation récente de l’EFPIA pour trois traitements oncologiques autorisés, y compris les traitements orphelins et les ATMP, ce qui a donné lieu à un grand nombre de PICO potentiels dans sept pays, allant de sept à 23 PICO après consolidation.
Résultats
Graphique 1. Nombre de pays demandant des données par rapport à des résultats cliniques spécifiés
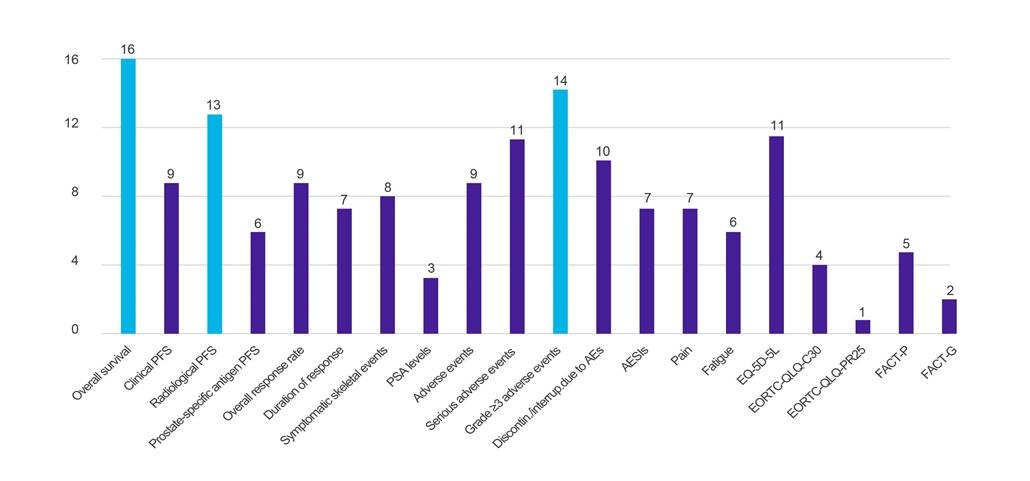
Légende : EI – événement indésirable ; AESI – événement indésirable présentant un intérêt particulier ; EORTC-QLQ-C30 – Questionnaire sur la qualité de vie de l’Organisation européenne pour la recherche et le traitement du cancer (-Core, 30 items) ; EORTC-QLQ-PR25 – Questionnaire sur la qualité de vie de l’Organisation européenne pour la recherche et le traitement du cancer (-Prostate, 25 questions) ; EQ-5D-5L – Niveau EuroQol-5 Dimension-5 ; FACT-G – Évaluation fonctionnelle du traitement du cancer – Général ; FACT-P – Évaluation fonctionnelle du traitement du cancer de la prostate ; SSP – survie sans progression ; PSA – antigène spécifique de la prostate.
En conclusion

À moins de deux mois de l’entrée en vigueur de la JCA, et alors que les directives méthodologiques sont toujours en attente, d’importantes incertitudes persistent tant pour l’industrie que pour les organismes d’ETS concernant le processus de détermination de la portée, qui constitue la base de la JCA. Les exercices PICO organisés par le HTACG et impliquant divers organes de l’ETS, ainsi que les simulations PICO menées par les HTD, sont cruciaux pour préparer les principales parties prenantes au prochain JCA en termes de capacités et de stratégie interne. Cependant, il reste à voir comment ces simulations se traduiront dans la JCA réelle et quel impact l’évaluation aura sur l’accès au marché local. L’ETS de l’UE fonctionnera comme un système d’apprentissage au cours des JCA initiaux, et la collaboration, les efforts et le retour d’information de toutes les parties prenantes seront essentiels pour créer un système efficace.
Bibliographie
-
EUnetHTA 21. Guide pratique. D4.2 Processus de détermination de la portée. Édition 1.0. 2022. Consulté le 23 septembre 2024. https://www.eunethta.eu/wp-content/uploads/2022/09/EUnetHTA-21-D4.2-practical-guideline-on-scoping-process-v1.0.pdf
-
EUnetHTA 21. PICO consolidé. Exercice PICO I – Pluvicto. Édition 1.0. 2023. Consulté le 23 septembre 2024. https://www.eunethta.eu/wp-content/uploads/2023/09/EUnetHTA-21-PICO-1-Deliverbale-1.pdf
-
Commission européenne. Règlement (CE) 2021/2282 du Parlement européen et du Conseil du 15 décembre 2021 relatif à l’évaluation des technologies de la santé et modifiant la directive 2011/24/UE. 2021. Consulté le 23 septembre 2024. https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32021R2282
-
Commission européenne. De la théorie à la pratique : mise en œuvre du règlement de l’UE sur l’évaluation des technologies de la santé. 2023. Consulté le 11 mai 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-05-11_en
-
Commission européenne. De la théorie à la pratique : mise en œuvre du règlement de l’UE sur l’évaluation des technologies de la santé. 2023. Consulté le 18 septembre 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-09-18_en
-
Commission européenne. De la théorie à la pratique : mise en œuvre du règlement de l’UE sur l’évaluation des technologies de la santé. 2023. Consulté le 22 novembre 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-11-22_en
-
Commission européenne. De la théorie à la pratique : mise en œuvre du règlement de l’UE sur l’évaluation des technologies de la santé. 2024. Consulté le 30 janvier 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-01-30_en
-
Commission européenne. De la théorie à la pratique : mise en œuvre du règlement de l’UE sur l’évaluation des technologies de la santé. 2024. Consulté le 9 avril 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-04-09_en
-
Commission européenne. De la théorie à la pratique : mise en œuvre du règlement de l’UE sur l’évaluation des technologies de la santé. 2024. Consulté le 23 septembre 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-09-06_en
-
Commission européenne. Plan continu de mise en œuvre 2023-2024. Mis à jour en septembre 2024. Consulté le 23 septembre 2024. https://health.ec.europa.eu/document/download/397b2a2e-1793-48fd-b9f5-7b8f0b05c7dd_en
-
Commission européenne. Évaluation des technologies de la santé – évaluations cliniques conjointes des dispositifs médicaux. 2024. Consulté le 5 novembre 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13707-Health-technology-assessment-joint-clinical-assessments-of-medical-devices_en
-
Commission européenne. Évaluation des technologies de la santé – évaluations cliniques conjointes des médicaments. 2024. Consulté le 24 septembre 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13708-Health-technology-assessment-joint-clinical-assessments-of-medicinal-products_en
-
Commission européenne. Évaluation des technologies de la santé – règles de procédure pour l’évaluation et la gestion des conflits d’intérêts. 2024. Consulté le 23 septembre 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13751-Health-technology-assessment-procedural-rules-for-assessing-and-managing-conflicts-of-interest_en
-
Commission européenne. Évaluation des technologies de la santé – coopération avec l’Agence européenne des médicaments. 2024. Consulté le 23 septembre 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/14164-Health-technology-assessment-cooperation-with-the-European-Medicines-Agency_en
-
Commission européenne. Évaluation des technologies de la santé – consultations scientifiques conjointes sur les dispositifs médicaux et les dispositifs médicaux de diagnostic in vitro. 2024. Consulté le 5 novembre 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13752-Health-technology-assessment-joint-scientific-consultations-on-medical-devices-in-vitro-diagnostic-medical-devices_en
-
Commission européenne. Évaluation des technologies de la santé – consultations scientifiques conjointes sur les médicaments à usage humain. 2024. Consulté le 22 octobre 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13759-Health-technology-assessment-Joint-scientific-consultations-on-medicinal-products-for-human-use_en
-
Commission européenne. Évaluation clinique conjointe des médicaments : soumission d’informations préliminaires par les développeurs de technologies de la santé. 2024. Consulté le 23 septembre 2024. https://health.ec.europa.eu/document/download/77476507-9ddc-47e3-ae0d-11c05f89169c_en?filename=hta_%20mp-jca_htd_en.pdf
-
Fédération européenne des industries et associations pharmaceutiques. Règlement de l’UE sur l’ETS pour les médicaments oncologiques : Enseignements tirés d’une simulation sur l’impact des méthodes EUnetHTA21 proposées. 2024. Consulté le 23 septembre 2024. https://www.efpia.eu/media/qrjah2ij/efpia-evidera-research-on-eunethta21-methods.pdf
-
Agence européenne des médicaments. Médicaments de thérapie innovante : Vue d’ensemble. 2024. Consulté le 23 septembre 2024. https://www.ema.europa.eu/en/human-regulatory-overview/advanced-therapy-medicinal-products-overview
-
HTACG. Spécifications scientifiques des médicaments faisant l’objet d’évaluations cliniques conjointes. 2024. Consulté le 23 septembre 2024. https://health.ec.europa.eu/document/download/48974c78-1c37-4cf9-9fc9-a630fee9baac_en?filename=hta_mp_jca_sc-specifications_en.pdf
-
O’Donnell R. De l’anxiété PICO à la stratégie PICO : planifier la réussite de l’ETS dans l’UE. 2024. Consulté le 23 septembre 2024. https://www.amerisourcebergen.com/insights/manufacturers/from-pico-anxiety-to-pico-strategy




