Manca poco all'inizio della valutazione clinica congiunta: L'ansia PICO diventerà realtà?

Sei pronto?
Sviluppi recenti
Specifiche scientifiche dei medicinali
Nuovo principio attivo |
Un nuovo principio attivo chimico, biologico o radiofarmaceutico che:
|
Trattamento del cancro |
|
ATMP |
|
Chiave: ATMP – medicinale per terapie avanzate; CE – Commissione Europea; UE – Unione Europea; HTACG – Gruppo di coordinamento per la valutazione delle tecnologie sanitarie; ICD-O – Classificazione Internazionale delle Malattie per l'Oncologia; JCA – Valutazione clinica congiunta.
Atti di esecuzione e documenti di orientamento in sospeso
Atto di esecuzione |
Scadenza |
Stato |
|
Norme procedurali per la JCA dei medicinali |
1°-2° trimestre 2024 |
Adottato il 23 maggio 2024 |
|
Norme sulla cooperazione mediante scambio di informazioni con l'EMA |
3° trimestre 2024 |
Adottato il 18 ottobre 2024 |
|
Norme procedurali per la gestione dei conflitti di interessi |
3° trimestre 2024 |
Adottata il 25 ottobre 2024 |
|
Norme procedurali per le JSC dei medicinali |
3° trimestre 2024 |
Versione finale in preparazione, consultazione pubblica chiusa |
|
Norme procedurali per le JSC dei dispositivi medici e dei dispositivi medici IVD |
4° trimestre 2024 |
Consultazione pubblica aperta fino al 26 novembre 2024 |
|
Norme procedurali per la JCA dei dispositivi medici e dei dispositivi medici IVD |
4° trimestre 2024 |
Pianificato |
Chiave: EMA – Agenzia europea per i medicinali; IVD – diagnostica in vitro; JCA – Valutazione Clinica Congiunta; JSC – Consultazione scientifica congiunta.
Inoltre, più di 10 documenti di orientamento sono attualmente in preparazione e dovrebbero essere pubblicati prima dell'entrata in vigore della JCA. Tra queste, le linee guida che descrivono la metodologia scientifica per il processo di definizione dell'ambito di applicazione sono particolarmente attese dalle parti interessate, in quanto si prevede che integrino le precedenti linee guida preliminari di EUnetHTA 21 su come sarà condotta questa "prima fase" del processo JCA, come la definizione del PICO (popolazione, intervento, comparatore, risultato) per l'ambito di applicazione della JCA.
Avvio del processo JCA da parte dello sviluppatore di tecnologie sanitarie

Definizione di PICO
Tabella 3. Confronto delle simulazioni PICO in mCRPC di EUnetHTA 21 e Cencora
|
|
EUnetHTA 21 |
Cencora |
|
Indicazione |
Pazienti adulti con carcinoma prostatico metastatico resistente alla castrazione (mCRPC) positivo positivo all'antigene prostatico prostatico progressivo (PSMA) che sono stati trattati con inibizione della via del recettore degli androgeni (AR) e chemioterapia a base di taxani |
|
|
Numero di Stati membri interessati |
8 (Paesi non specificati) |
16 (Belgio, Repubblica Ceca, Danimarca, Finlandia, Francia, Germania, Grecia, Irlanda, Italia, Lussemburgo, Paesi Bassi, Norvegia, Polonia, Portogallo, Spagna e Svezia) |
|
Risultati (n.) |
|
|
|
Popolazioni |
Popolazione autorizzata completa + 4 sottopopolazioni |
Popolazione autorizzata completa + 4 sottopopolazioni |
|
Intervento |
Pluvicto |
Cenpicomab |
|
Comparatori |
6 |
12 |
|
Risultati |
21 |
20 (vedi Figura 1) |
|
PICO consolidati |
6, di cui 2 per l'intera popolazione autorizzata |
18, di cui 9 per l'intera popolazione autorizzata (cfr. tabella 4) |
|
Data dell'indagine PICO |
Novembre 2022 |
Maggio 2024 |
Chiave: no. –numero; PICO – popolazione, intervento, comparatore, esito.
Il confronto tra le due simulazioni mostra che l'inclusione di una gamma più ampia di Stati membri e l'estensione del calendario per l'acquisizione dei comparatori approvati più di recente possono portare a un aumento significativo dei PICO consolidati da prendere in considerazione per l'ambito di applicazione della JCA a causa delle variazioni nelle linee guida cliniche, negli standard di trattamento e nella velocità di accesso al mercato dei nuovi medicinali nei paesi dell'UE.
Comparatori
Secondo le linee guida pratiche di EUnetHTA 21, ogni comparatore richiesto nei paesi inclusi si traduce in un PICO separato per l'ambito della valutazione. Seguendo questa linea guida pratica, l'analisi di Cencora ha portato a un numero elevato di PICO per l'intera popolazione, trainato dall'obbligo per cinque dei 16 paesi (Germania, Irlanda, Italia, Portogallo e Spagna) di includere tutti i comparatori rilevanti a livello locale nella valutazione clinica, coprendo una gamma che va da due comparatori in Italia a sette comparatori in Portogallo. Al contrario, tre paesi (Repubblica ceca, Francia e Paesi Bassi) hanno dichiarato che la valutazione rispetto a un comparatore pertinente a livello locale era sufficiente, un altro paese (Polonia) ha affermato che il comparatore pertinente sarebbe stato selezionato in base alla quota di mercato più elevata e cinque paesi (Belgio, Danimarca, Finlandia, Norvegia e Svezia) hanno sottolineato che l'opzione terapeutica pertinente dipenderebbe dal posizionamento del prodotto (ossia la linea di trattamento) da parte dell'HTD. In Lussemburgo, la valutazione si basa sul fascicolo presentato nel «pays de provenance» ufficiale (ossia il paese d'origine, di solito il Belgio). In Grecia, solo un comparatore è stato considerato pertinente per l'ambito della valutazione. La tabella 4 mostra i PICO identificati per l'intera popolazione di cenpicomab.
Per l'analisi EUnetHTA 21 non sono stati pubblicati i requisiti specifici per paese, il che riflette il processo di definizione dell'ambito di applicazione nel quadro della JCA, in cui le risposte dei singoli paesi non saranno messe a disposizione degli HTD.
|
|
Comparatori di interesse per l'intera popolazione per cenpicomab |
Paesi che richiedono ciascun comparatore |
PICO 1 |
Abiraterone + prednisone/prednisolone |
BE, DE, FI, FR, IE, LU, NL, NO, PT, SE |
PICO 2 |
Migliore terapia di supporto* |
DE,DK, ES, FI, IE, NL, NO, SE |
PICO 3 |
Cabazitaxel + prednisone/prednisolone* |
BE, DE,DK, ES, FI, IE, IT, LU, NL, NO, PT, SE |
PICO 4 |
Docetaxel + prednisone/prednisolone* |
BE, DK, FI, IE, LU, NL, NO, PT, SE |
PICO 5 |
Enzalutamide |
BE, DE,DK, FI, FR, IE, LU, NL, NO, PT, SE |
PICO 6 |
Lutezio (177Lu) vipivotide tetraxetan + terapia di deprivazione androgenica* |
BE, DE, FI, GR, IE, IT,NL, PO, PT |
PICO 7 |
Olaparib* |
DK, PT |
PICO 8 |
Radio-223* |
ES, FI, PO |
PICO 9 |
Radio-223 + analogo dell'ormone di rilascio dell'ormone luteinizzante* |
PO, PT |
Chiave: BE – Belgio; CZ – Repubblica Ceca; DE – Germania; DK – Danimarca; ES – Spagna; FI – Finlandia; FR – Francia; GR – Grecia; IE – Irlanda; IT – Italia; LU – Lussemburgo; NL – Paesi Bassi; NO – Norvegia; PICO – popolazione, intervento, comparatore, esito; PO – Polonia; PT – Portogallo; SE – Svezia.
Nota: I paesi in grassetto rappresentano i paesi da cui è stato derivato il PICO a causa della richiesta di dati relativi a tutti i comparatori identificati.
*Comparatori considerati anche nei PICO per sottopopolazioni (non presentati qui).
La possibilità di PICO estesi derivanti dalla fase di scoping è stata confermata in una recente simulazione EFPIA per tre trattamenti oncologici autorizzati, tra cui orfani e ATMP, che ha portato a un gran numero di potenziali PICO in sette paesi, che vanno da sette a 23 PICO dopo il consolidamento.
Risultati
Figura 1. Numero di paesi che richiedono dati rispetto a risultati clinici specificati
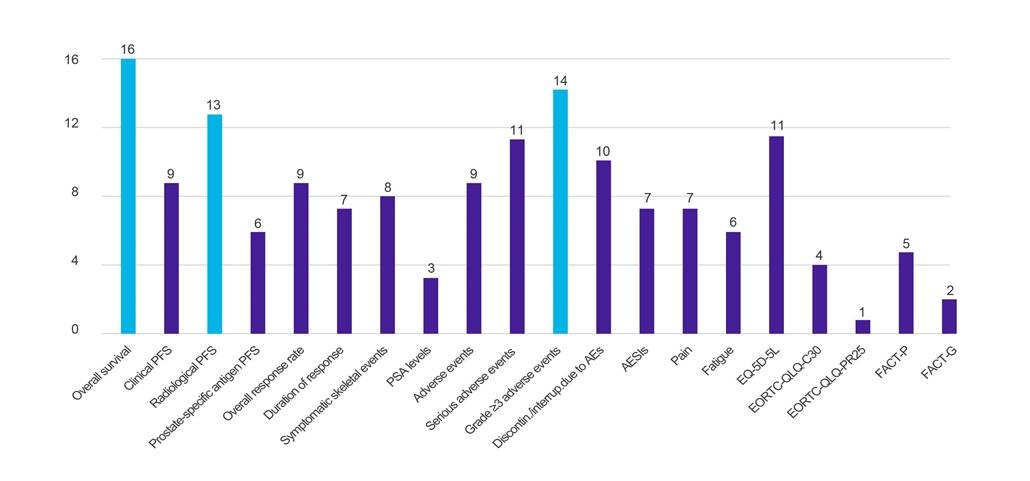
Chiave: AE – evento avverso; AESI – evento avverso di particolare interesse; EORTC-QLQ-C30 – Questionario sulla qualità della vita dell'Organizzazione europea per la ricerca e il trattamento del cancro (-Core, 30 item); EORTC-QLQ-PR25 – Questionario sulla qualità della vita dell'Organizzazione europea per la ricerca e il trattamento del cancro (-Prostata, 25 item); EQ-5D-5L – Livello EuroQol-5 Dimensione-5; FACT-G – Valutazione Funzionale della Terapia del Cancro-Generale; FACT-P – Valutazione Funzionale della Terapia Oncologica-Prostata; PFS – sopravvivenza libera da progressione; PSA – antigene prostatico specifico.
Conclusioni

A meno di due mesi dall'entrata in vigore della JCA e con linee guida metodologiche ancora in sospeso, permangono incertezze significative sia per l'industria che per gli organismi HTA per quanto riguarda il processo di definizione dell'ambito di applicazione, che costituisce la base della JCA. Le esercitazioni PICO organizzate dall'HTACG e che coinvolgono vari organismi HTA, nonché le simulazioni PICO condotte dagli HTD, sono fondamentali per preparare le principali parti interessate alla prossima JCA in termini di capacità e strategia interna. Tuttavia, resta da vedere come queste simulazioni si tradurranno nell'effettiva JCA e quale impatto avrà la valutazione sull'accesso al mercato locale. L'UE HTA funzionerà come un sistema di apprendimento durante le JCA iniziali e la collaborazione, l'impegno e il feedback di tutte le parti interessate saranno essenziali per creare un sistema efficiente.
Fonti
-
EUnetHTA 21. Linee guida pratiche. D4.2 Processo di scoping. Versione 1.0. 2022. Accesso effettuato il 23 settembre 2024. https://www.eunethta.eu/wp-content/uploads/2022/09/EUnetHTA-21-D4.2-practical-guideline-on-scoping-process-v1.0.pdf
-
EUnetHTA 21. PICO consolidato. Esercizio PICO I – Pluvicto. Versione 1.0. 2023. Accesso effettuato il 23 settembre 2024. https://www.eunethta.eu/wp-content/uploads/2023/09/EUnetHTA-21-PICO-1-Deliverbale-1.pdf
-
Commissione europea. Regolamento (CE) 2021/2282 del Parlamento europeo e del Consiglio, del 15 dicembre 2021, relativo alla valutazione delle tecnologie sanitarie e che modifica la direttiva 2011/24/UE. 2021. Accesso effettuato il 23 settembre 2024. https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32021R2282
-
Commissione europea. Dalla teoria alla pratica: attuazione del regolamento UE sulla valutazione delle tecnologie sanitarie. 2023. Accesso effettuato l'11 maggio 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-05-11_en
-
Commissione europea. Dalla teoria alla pratica: attuazione del regolamento UE sulla valutazione delle tecnologie sanitarie. 2023. Accesso effettuato il 18 settembre 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-09-18_en
-
Commissione europea. Dalla teoria alla pratica: attuazione del regolamento UE sulla valutazione delle tecnologie sanitarie. 2023. Accesso effettuato il 22 novembre 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-11-22_en
-
Commissione europea. Dalla teoria alla pratica: attuazione del regolamento UE sulla valutazione delle tecnologie sanitarie. 2024. Consultato il 30 gennaio 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-01-30_en
-
Commissione europea. Dalla teoria alla pratica: attuazione del regolamento UE sulla valutazione delle tecnologie sanitarie. 2024. Accesso effettuato il 9 aprile 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-04-09_en
-
Commissione europea. Dalla teoria alla pratica: attuazione del regolamento UE sulla valutazione delle tecnologie sanitarie. 2024. Accesso effettuato il 23 settembre 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-09-06_en
-
Commissione europea. Piano di implementazione 2023-2024. Aggiornato a settembre 2024. Accesso effettuato il 23 settembre 2024. https://health.ec.europa.eu/document/download/397b2a2e-1793-48fd-b9f5-7b8f0b05c7dd_en
-
Commissione europea. Valutazione delle tecnologie sanitarie – valutazioni cliniche congiunte dei dispositivi medici. 2024. Accesso effettuato il 5 novembre 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13707-Health-technology-assessment-joint-clinical-assessments-of-medical-devices_en
-
Commissione europea. Valutazione delle tecnologie sanitarie – valutazioni cliniche congiunte dei medicinali. 2024. Accesso effettuato il 24 settembre 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13708-Health-technology-assessment-joint-clinical-assessments-of-medicinal-products_en
-
Commissione europea. Valutazione delle tecnologie sanitarie: norme procedurali per la valutazione e la gestione dei conflitti di interesse. 2024. Accesso effettuato il 23 settembre 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13751-Health-technology-assessment-procedural-rules-for-assessing-and-managing-conflicts-of-interest_en
-
Commissione europea. Valutazione delle tecnologie sanitarie – cooperazione con l'Agenzia europea per i medicinali. 2024. Accesso effettuato il 23 settembre 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/14164-Health-technology-assessment-cooperation-with-the-European-Medicines-Agency_en
-
Commissione europea. Valutazione delle tecnologie sanitarie – consultazioni scientifiche congiunte sui dispositivi medici e sui dispositivi medico-diagnostici in vitro. 2024. Accesso effettuato il 5 novembre 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13752-Health-technology-assessment-joint-scientific-consultations-on-medical-devices-in-vitro-diagnostic-medical-devices_en
-
Commissione europea. Valutazione delle tecnologie sanitarie – consultazioni scientifiche congiunte sui medicinali per uso umano. 2024. Accesso effettuato il 22 ottobre 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13759-Health-technology-assessment-Joint-scientific-consultations-on-medicinal-products-for-human-use_en
-
Commissione europea. Valutazione clinica congiunta dei medicinali: presentazione di informazioni preliminari da parte degli sviluppatori di tecnologie sanitarie. 2024. Accesso effettuato il 23 settembre 2024. https://health.ec.europa.eu/document/download/77476507-9ddc-47e3-ae0d-11c05f89169c_en?filename=hta_%20mp-jca_htd_en.pdf
-
Federazione europea delle industrie e delle associazioni farmaceutiche. Regolamento HTA dell'UE per i farmaci oncologici: Insegnamenti da una simulazione sull'impatto dei metodi EUnetHTA21 proposti. 2024. Accesso effettuato il 23 settembre 2024. https://www.efpia.eu/media/qrjah2ij/efpia-evidera-research-on-eunethta21-methods.pdf
-
Agenzia europea per i medicinali. Medicinali per terapie avanzate: Panoramica. 2024. Accesso effettuato il 23 settembre 2024. https://www.ema.europa.eu/en/human-regulatory-overview/advanced-therapy-medicinal-products-overview
-
HTACG. Specifiche scientifiche dei medicinali soggetti a valutazioni cliniche congiunte. 2024. Accesso effettuato il 23 settembre 2024. https://health.ec.europa.eu/document/download/48974c78-1c37-4cf9-9fc9-a630fee9baac_en?filename=hta_mp_jca_sc-specifications_en.pdf
-
O'Donnell R. Dall'ansia PICO alla strategia PICO: pianificare il successo dell'HTA nell'UE. 2024. Accesso effettuato il 23 settembre 2024. https://www.amerisourcebergen.com/insights/manufacturers/from-pico-anxiety-to-pico-strategy




