Articolo
Esplorazione dei confronti indiretti nelle valutazioni delle tecnologie sanitarie: Approfondimenti dalle valutazioni tedesche di AMNOG
Nell'intricato mondo della valutazione delle tecnologie sanitarie, i confronti indiretti sono spesso risorse indispensabili per valutare nuovi farmaci quando non sono disponibili prove dirette. Questo articolo approfondisce il rigoroso panorama delle valutazioni AMNOG tedesche, rivelando le intuizioni chiave e le priorità che plasmano il futuro dell'innovazione sanitaria.
Un primo passo essenziale nel processo di HTA è dimostrare che la metodologia utilizzata per generare dati comparativi rispetto all'ACT è appropriata. Se la Commissione paritetica federale (G-BA) accetta la metodologia, tutti i dati vengono presi in considerazione nella valutazione delle prestazioni aggiuntive. Tuttavia, se un IC non viene accettato, questi dati vengono ignorati e la valutazione del beneficio aggiunto si basa solo su prove dirette.
I criteri di accettazione per i circuiti integrati sono rigorosi e il successo spesso dipende da circostanze speciali. I limiti metodologici, come l'eterogeneità tra gli studi e le distorsioni intrinseche nelle evidenze sul lato del comparatore, possono introdurre incertezza nelle valutazioni comparative. È essenziale che i ricercatori e i valutatori affrontino in modo trasparente queste limitazioni e impieghino metodologie solide per migliorare la validità e l'affidabilità dei risultati dell'IC. Le linee guida sui metodi relativi ai requisiti per gli IC sono fornite dall'Istituto per la qualità e l'efficienza nell'assistenza sanitaria (IQWiG). Inoltre, gli sviluppatori di farmaci possono programmare un ulteriore incontro di consulenza con il G-BA per ottenere ulteriori approfondimenti sulla metodologia appropriata. Questo articolo esplora i risultati delle recenti analisi degli IC nelle valutazioni AMNOG tedesche, evidenziando i rigorosi criteri per l'accettazione e le implicazioni per vari campi terapeutici.
I criteri di accettazione per i circuiti integrati sono rigorosi e il successo spesso dipende da circostanze speciali. I limiti metodologici, come l'eterogeneità tra gli studi e le distorsioni intrinseche nelle evidenze sul lato del comparatore, possono introdurre incertezza nelle valutazioni comparative. È essenziale che i ricercatori e i valutatori affrontino in modo trasparente queste limitazioni e impieghino metodologie solide per migliorare la validità e l'affidabilità dei risultati dell'IC. Le linee guida sui metodi relativi ai requisiti per gli IC sono fornite dall'Istituto per la qualità e l'efficienza nell'assistenza sanitaria (IQWiG). Inoltre, gli sviluppatori di farmaci possono programmare un ulteriore incontro di consulenza con il G-BA per ottenere ulteriori approfondimenti sulla metodologia appropriata. Questo articolo esplora i risultati delle recenti analisi degli IC nelle valutazioni AMNOG tedesche, evidenziando i rigorosi criteri per l'accettazione e le implicazioni per vari campi terapeutici.
Metodi
È stata effettuata una ricerca sistematica di IC utilizzando un database interno AMNOG contenente tutte le valutazioni dei benefici pubblicate sul sito web del G-BA fino ad aprile 2024. La valutazione degli IC da parte del G-BA e i relativi benefici medici aggiuntivi sono stati ottenuti dalla banca dati. Questa analisi completa ha incluso 222 valutazioni dei benefici completate che comprendono 334 sottopopolazioni.
Risultati
Tra le 334 sottopopolazioni per le quali è stato presentato un IC, i campi terapeutici predominanti sono stati le malattie oncologiche (51,2%), metaboliche (15,0%) e infettive (11,4%) (Figura 1). Nel 22,5% dei casi, l'IC è stato accettato dal G-BA (Figura 2). Le carenze metodologiche e l'insufficiente somiglianza degli studi confrontati sono state le ragioni principali del rifiuto di un IC da parte del G-BA (Figura 3).
Figura 1. I CI nelle valutazioni dei benefici in Germania per settore terapeutico
I rigorosi criteri del G-BA garantiscono che vengano accettati solo circuiti integrati robusti e affidabili. Questa enfasi sul rigore metodologico è fondamentale per mantenere l'integrità dei processi HTA. Di norma, il G-BA richiede confronti adeguati, come l'IC secondo Bucher. Tuttavia, sono stati identificati sia confronti aggiustati che non aggiustati tra gli IC accettati, mentre altri metodi, come le meta-analisi di rete o la corrispondenza del punteggio di propensione, non sono stati considerati metodologicamente appropriati. Di conseguenza, l'analisi del database ha mostrato che i confronti non aggiustati possono anche essere ritenuti accettabili in determinate circostanze, ad esempio in popolazioni altamente vulnerabili o quando si affrontano sfide significative all'interno del campo terapeutico.
Figura 2. Accettazione dei circuiti integrati da parte del G-BA
Ad esempio, nel caso dell'infezione cronica da virus dell'epatite C, le terapie combinate contenenti interferone sono state definite ACT prima del 2014. Gli interferoni sono associati a effetti collaterali significativi, tra cui depressione e pensieri suicidi. Dato il successo del trattamento che può essere ottenuto con i nuovi farmaci sofosbuvir ed elbasvir/grazoprevir, insieme alla possibilità di durate di terapia più brevi e di evitare gravi effetti collaterali correlati all'interferone, si è ritenuto necessario, per ragioni etiche, prendere in considerazione studi non controllati a braccio singolo in cui questi nuovi farmaci sono stati confrontati con i controlli storici. Pertanto, un confronto corretto non era fattibile e, in questo caso, un confronto non corretto è stato accettato dal G-BA.
Particolare attenzione viene data anche alle popolazioni altamente vulnerabili, come i pazienti pediatrici o quelli con malattie rare. In questi casi, gli RCT potrebbero non essere eticamente fattibili da condurre. Nel contesto del deficit di lipasi acida lisosomiale, ad esempio, una malattia rara che in genere provoca un aumento della mortalità entro il primo anno di vita senza alternative terapeutiche disponibili al momento della valutazione, il produttore ha fornito agli IC controlli storici per superare la mancanza di prove comparative dirette. Il G-BA ha accettato questa metodologia e ha concluso che i risultati dell'IC escludevano la possibilità che il guadagno dimostrato nella sopravvivenza globale potesse essere spiegato solo dall'incertezza metodologica. Pertanto, il G-BA ha concesso un accenno di un beneficio aggiuntivo non quantificabile alla sebelipasi alfa. Questo è un esempio dell'accettazione di un IC non regolato in ulteriori circostanze eccezionali.
Figura 3. Motivi del rifiuto dei circuiti integrati da parte del G-BA
Figura 1. I CI nelle valutazioni dei benefici in Germania per settore terapeutico
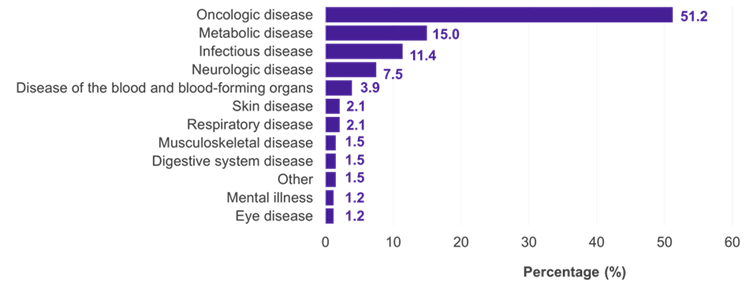
Chiave: IC – confronto indiretto.

I rigorosi criteri del G-BA garantiscono che vengano accettati solo circuiti integrati robusti e affidabili. Questa enfasi sul rigore metodologico è fondamentale per mantenere l'integrità dei processi HTA. Di norma, il G-BA richiede confronti adeguati, come l'IC secondo Bucher. Tuttavia, sono stati identificati sia confronti aggiustati che non aggiustati tra gli IC accettati, mentre altri metodi, come le meta-analisi di rete o la corrispondenza del punteggio di propensione, non sono stati considerati metodologicamente appropriati. Di conseguenza, l'analisi del database ha mostrato che i confronti non aggiustati possono anche essere ritenuti accettabili in determinate circostanze, ad esempio in popolazioni altamente vulnerabili o quando si affrontano sfide significative all'interno del campo terapeutico.
Figura 2. Accettazione dei circuiti integrati da parte del G-BA
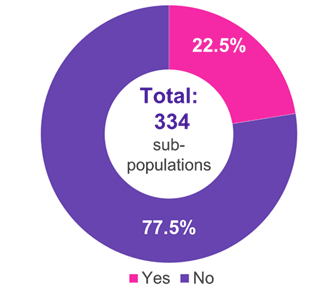
Chiave: G-BA – Comitato misto federale; IC – confronto indiretto.

Ad esempio, nel caso dell'infezione cronica da virus dell'epatite C, le terapie combinate contenenti interferone sono state definite ACT prima del 2014. Gli interferoni sono associati a effetti collaterali significativi, tra cui depressione e pensieri suicidi. Dato il successo del trattamento che può essere ottenuto con i nuovi farmaci sofosbuvir ed elbasvir/grazoprevir, insieme alla possibilità di durate di terapia più brevi e di evitare gravi effetti collaterali correlati all'interferone, si è ritenuto necessario, per ragioni etiche, prendere in considerazione studi non controllati a braccio singolo in cui questi nuovi farmaci sono stati confrontati con i controlli storici. Pertanto, un confronto corretto non era fattibile e, in questo caso, un confronto non corretto è stato accettato dal G-BA.
Particolare attenzione viene data anche alle popolazioni altamente vulnerabili, come i pazienti pediatrici o quelli con malattie rare. In questi casi, gli RCT potrebbero non essere eticamente fattibili da condurre. Nel contesto del deficit di lipasi acida lisosomiale, ad esempio, una malattia rara che in genere provoca un aumento della mortalità entro il primo anno di vita senza alternative terapeutiche disponibili al momento della valutazione, il produttore ha fornito agli IC controlli storici per superare la mancanza di prove comparative dirette. Il G-BA ha accettato questa metodologia e ha concluso che i risultati dell'IC escludevano la possibilità che il guadagno dimostrato nella sopravvivenza globale potesse essere spiegato solo dall'incertezza metodologica. Pertanto, il G-BA ha concesso un accenno di un beneficio aggiuntivo non quantificabile alla sebelipasi alfa. Questo è un esempio dell'accettazione di un IC non regolato in ulteriori circostanze eccezionali.
Figura 3. Motivi del rifiuto dei circuiti integrati da parte del G-BA
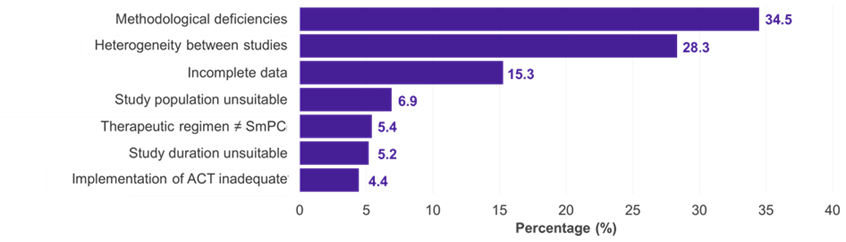
Chiave: ACT – terapia comparativa appropriata; G-BA – Comitato misto federale; IC – confronto indiretto; RCP – riepilogo delle caratteristiche del prodotto.


Conclusione
In conclusione, l'analisi degli IC nell'ambito delle valutazioni AMNOG tedesche evidenzia la complessità e gli elevati standard richiesti per tali valutazioni. I rigorosi criteri stabiliti dal G-BA garantiscono che siano accettati solo circuiti integrati solidi e metodologicamente validi, sottolineando la necessità di approcci metodologici trasparenti e rigorosi per garantire la validità e l'affidabilità dei risultati. Sebbene solo una piccola percentuale di IC sia alla fine accettata, gli IC continueranno a fornire prove critiche in contesti terapeutici specifici, come le popolazioni vulnerabili.
I risultati illustrano che, in determinate circostanze, possono essere accettati confronti aggiustati e non aggiustati, in particolare quando considerazioni etiche precludono studi diretti testa a testa e il trattamento di pazienti con malattie rare o gravi è prioritario. In sintesi e dal punto di vista HTA, è innanzitutto opportuno valutare attentamente la fattibilità di condurre RCT. Nei casi in cui un RCT non è fattibile, gli IC sono un metodo adatto per compensare la mancanza di dati comparativi diretti, ma la scelta di una metodologia appropriata è fondamentale. Per massimizzare la probabilità di accettazione nel contesto tedesco, si consiglia di attenersi strettamente ai severi criteri del G-BA.
Autori

Le valutazioni delle tecnologie sanitarie (HTA) sono essenziali per determinare il valore e l'impatto dei nuovi prodotti farmaceutici sui sistemi sanitari. In Germania, il processo AMNOG (Legge sulla riorganizzazione del mercato farmaceutico) richiede alle aziende farmaceutiche di dimostrare il beneficio medico dei farmaci appena approvati rispetto a un'appropriata terapia di confronto (ACT). Per ottenere un ulteriore beneficio medico, i dati devono dimostrare un vantaggio del farmaco valutato rispetto all'ACT oltre una soglia stabilita. Mentre gli studi randomizzati controllati (RCT) sono il gold standard per le evidenze, i confronti indiretti (IC) diventano spesso necessari quando i confronti diretti testa a testa non sono fattibili.
Fonti
-
Bucher HC, Guyatt GH, Griffith LE, et al. I risultati dei confronti diretti e indiretti dei trattamenti nella meta-analisi di studi randomizzati controllati. J Clin Epidemiol. 1997; 50(6):683-691. https://dx.doi.org/10.1016/s0895-4356(97)00049-8
-
Comitato misto federale (G-BA). 2014. Frühe Nutzenbewertung: Beträchtlicher Zusatznutzen für Wirkstoff gegen chronische hepatitis C. Consultato il 31 ottobre 2024. https://www.g-ba.de/presse/pressemitteilungen-meldungen/546/
-
Comitato misto federale (G-BA). 2017. AM-RL-XII Elbasvir-Grazoprevir. Accesso effettuato il 31 ottobre 2024. https://www.g-ba.de/downloads/40-268-4429/2017-06-15_AM-RL-XII_Elbasvir-Grazoprevir_D-268_TrG.pdf
-
Comitato misto federale (G-BA). 2021. AM-RL-XII Sebelipasi alfa. Accesso effettuato il 31 ottobre 2024. https://www.g-ba.de/downloads/40-268-7570/2021-06-03_AM-RL-XII_Sebelipase-alfa_D-606_TrG.pdf
-
Comitato misto federale (G-BA). 2024. Banca dati delle valutazioni dei benefici. Accesso effettuato il 31 ottobre 2024. https://www.g-ba.de/
-
Istituto per la qualità e l'efficienza nell'assistenza sanitaria (IQWiG). 2023. Metodi generali versione 7.0. 19 settembre 2023. https://www.iqwig.de/methoden/general-methods_version-7-0.pdf
-
Warmbold B, Scharrenbroich J, Teich K, Ingendoh-Tsakmakidis A, Löpmeier-Röh J, Kulp W. Confronti indiretti nelle valutazioni AMNOG tedesche: mantenere la fede. Presentato a: Congresso Europeo Annuale ISPOR; Barcellona, Spagna; 2024.
Questo articolo riassume la comprensione dell'argomento da parte di Cencora sulla base delle informazioni pubblicamente disponibili al momento della stesura (si vedano le fonti elencate) e l'esperienza degli autori in questo settore. Eventuali raccomandazioni fornite nell'articolo potrebbero non essere applicabili a tutte le situazioni e non costituiscono una consulenza legale; I lettori non dovrebbero fare affidamento sull'articolo nel prendere decisioni relative agli argomenti discussi.





