Artículo
Navegar por las comparaciones indirectas en las evaluaciones de tecnologías sanitarias: Perspectivas de las evaluaciones alemanas de AMNOG
En el intrincado mundo de la evaluación de tecnologías sanitarias, las comparaciones indirectas suelen ser recursos indispensables para evaluar nuevos productos farmacéuticos cuando no se dispone de pruebas directas. Este artículo profundiza en el riguroso panorama de las evaluaciones alemanas de AMNOG, revelando ideas y prioridades clave que dan forma al futuro de la innovación en el sector sanitario.
Un primer paso esencial en el proceso de ETS es demostrar que la metodología utilizada para generar datos comparativos con el TCA es adecuada. Si el Comité Federal Conjunto (G-BA) acepta la metodología, todos los datos se tienen en cuenta en la evaluación de los beneficios adicionales. Sin embargo, si no se acepta un CI, estos datos no se tienen en cuenta y la evaluación del beneficio adicional se basa únicamente en pruebas directas.
Los criterios de aceptación de los CI son estrictos, y el éxito a menudo depende de circunstancias especiales. Las limitaciones metodológicas, como la heterogeneidad entre los estudios y los sesgos inherentes a la evidencia en el lado del comparador, pueden introducir incertidumbre en las evaluaciones comparativas. Es esencial que los investigadores y evaluadores aborden de forma transparente estas limitaciones y empleen metodologías sólidas para mejorar la validez y fiabilidad de los resultados del CI. La guía de métodos con respecto a los requisitos para los CI es proporcionada por el Instituto para la Calidad y la Eficiencia en el Cuidado de la Salud (IQWiG). Además, los desarrolladores de fármacos pueden programar una reunión de asesoramiento adicional con el G-BA para obtener más información sobre la metodología adecuada. Este artículo explora los hallazgos de los análisis recientes de los CI en las evaluaciones alemanas de AMNOG, destacando los estrictos criterios de aceptación y las implicaciones para varios campos terapéuticos.
Los criterios de aceptación de los CI son estrictos, y el éxito a menudo depende de circunstancias especiales. Las limitaciones metodológicas, como la heterogeneidad entre los estudios y los sesgos inherentes a la evidencia en el lado del comparador, pueden introducir incertidumbre en las evaluaciones comparativas. Es esencial que los investigadores y evaluadores aborden de forma transparente estas limitaciones y empleen metodologías sólidas para mejorar la validez y fiabilidad de los resultados del CI. La guía de métodos con respecto a los requisitos para los CI es proporcionada por el Instituto para la Calidad y la Eficiencia en el Cuidado de la Salud (IQWiG). Además, los desarrolladores de fármacos pueden programar una reunión de asesoramiento adicional con el G-BA para obtener más información sobre la metodología adecuada. Este artículo explora los hallazgos de los análisis recientes de los CI en las evaluaciones alemanas de AMNOG, destacando los estrictos criterios de aceptación y las implicaciones para varios campos terapéuticos.
Métodos
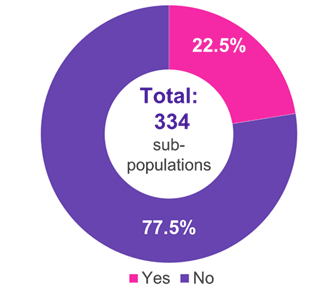
Se realizó una búsqueda sistemática de CI utilizando una base de datos interna de AMNOG que contenía todas las evaluaciones de beneficios publicadas en el sitio web del G-BA hasta abril de 2024. De la base de datos se obtuvo la evaluación de los CI por el G-BA y los beneficios médicos añadidos asociados. Este análisis exhaustivo incluyó 222 evaluaciones de beneficios completas que abarcaron 334 subpoblaciones.
Resultados
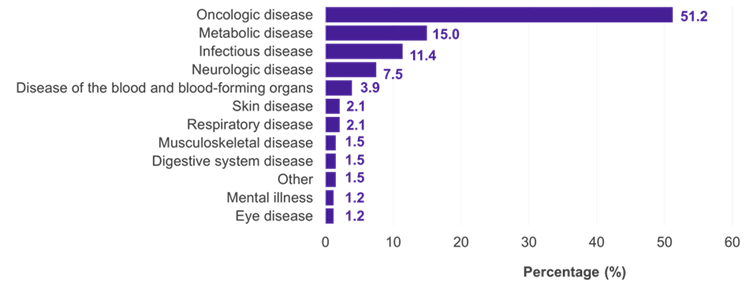
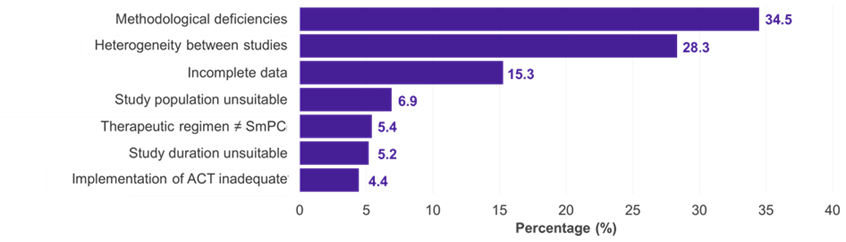
Entre las 334 subpoblaciones para las que se presentó un CI, los campos terapéuticos predominantes fueron las enfermedades oncológicas (51,2%), metabólicas (15,0%) e infecciosas (11,4%) (Figura 1). En el 22,5% de los casos, el CI fue aceptado por el G-BA (Figura 2). Las deficiencias metodológicas y la insuficiente similitud de los estudios comparados fueron las principales razones para el rechazo de un CI por parte del G-BA (Figura 3).
Figura 1. Evaluaciones de beneficios de los CI en Alemania por campo terapéutico
Los rigurosos criterios de la G-BA garantizan que solo se acepten circuitos integrados robustos y fiables. Este énfasis en el rigor metodológico es crucial para mantener la integridad de los procesos de ETS. Como regla general, el G-BA requiere comparaciones ajustadas, como el CI según Bucher. Sin embargo, se identificaron comparaciones ajustadas y no ajustadas entre los CI aceptados, mientras que otros métodos, como los metanálisis de redes o el emparejamiento de puntuaciones de propensión, no se consideraron metodológicamente apropiados. En consecuencia, el análisis de la base de datos mostró que las comparaciones no ajustadas también pueden considerarse aceptables en ciertas circunstancias, como en poblaciones altamente vulnerables o cuando se enfrentan a desafíos significativos dentro del campo terapéutico.
Figura 2. Aceptación de los CI por parte del G-BA
Por ejemplo, en el caso de la infección crónica por el virus de la hepatitis C, las terapias combinadas que contienen interferón se definieron como TCA antes de 2014. Los interferones se asocian con efectos secundarios significativos, como depresión y pensamientos suicidas. Dado el éxito del tratamiento que se puede lograr con los nuevos fármacos sofosbuvir y elbasvir/grazoprevir, junto con la posibilidad de que el tratamiento dure más corto y evite los efectos secundarios graves relacionados con el interferón, se consideró necesario, por razones éticas, considerar estudios no controlados de un solo grupo en los que estos nuevos fármacos se compararan con los controles históricos. Por lo tanto, no era factible realizar una comparación ajustada y, en este caso, el G-BA aceptó una comparación no ajustada.
También se tienen en cuenta especialmente las poblaciones altamente vulnerables, como los pacientes pediátricos o aquellos con enfermedades raras. En esos casos, es posible que no sea éticamente factible realizar ECA. En el contexto de la deficiencia de lipasa ácida lisosomal, por ejemplo, una enfermedad rara que generalmente resulta en un aumento de la mortalidad dentro del primer año de vida sin alternativas de tratamiento disponibles en el momento de la evaluación, el fabricante proporcionó a los CI controles históricos para superar la falta de evidencia comparativa directa. El G-BA aceptó esta metodología y concluyó que los resultados del CI descartaban la posibilidad de que la ganancia demostrada en la supervivencia global solo pudiera explicarse por la incertidumbre metodológica. Por lo tanto, el G-BA otorgó un indicio de un beneficio adicional no cuantificable a la sebelipasa alfa. Este es un ejemplo de la aceptación de un CI no ajustado en circunstancias excepcionales adicionales.
Figura 3. Razones para el rechazo de los CI por parte del G-BA
Figura 1. Evaluaciones de beneficios de los CI en Alemania por campo terapéutico
Llave: IC – comparación indirecta.

Los rigurosos criterios de la G-BA garantizan que solo se acepten circuitos integrados robustos y fiables. Este énfasis en el rigor metodológico es crucial para mantener la integridad de los procesos de ETS. Como regla general, el G-BA requiere comparaciones ajustadas, como el CI según Bucher. Sin embargo, se identificaron comparaciones ajustadas y no ajustadas entre los CI aceptados, mientras que otros métodos, como los metanálisis de redes o el emparejamiento de puntuaciones de propensión, no se consideraron metodológicamente apropiados. En consecuencia, el análisis de la base de datos mostró que las comparaciones no ajustadas también pueden considerarse aceptables en ciertas circunstancias, como en poblaciones altamente vulnerables o cuando se enfrentan a desafíos significativos dentro del campo terapéutico.
Figura 2. Aceptación de los CI por parte del G-BA
Llave: G-BA – Comité Conjunto Federal; IC – comparación indirecta.

Por ejemplo, en el caso de la infección crónica por el virus de la hepatitis C, las terapias combinadas que contienen interferón se definieron como TCA antes de 2014. Los interferones se asocian con efectos secundarios significativos, como depresión y pensamientos suicidas. Dado el éxito del tratamiento que se puede lograr con los nuevos fármacos sofosbuvir y elbasvir/grazoprevir, junto con la posibilidad de que el tratamiento dure más corto y evite los efectos secundarios graves relacionados con el interferón, se consideró necesario, por razones éticas, considerar estudios no controlados de un solo grupo en los que estos nuevos fármacos se compararan con los controles históricos. Por lo tanto, no era factible realizar una comparación ajustada y, en este caso, el G-BA aceptó una comparación no ajustada.
También se tienen en cuenta especialmente las poblaciones altamente vulnerables, como los pacientes pediátricos o aquellos con enfermedades raras. En esos casos, es posible que no sea éticamente factible realizar ECA. En el contexto de la deficiencia de lipasa ácida lisosomal, por ejemplo, una enfermedad rara que generalmente resulta en un aumento de la mortalidad dentro del primer año de vida sin alternativas de tratamiento disponibles en el momento de la evaluación, el fabricante proporcionó a los CI controles históricos para superar la falta de evidencia comparativa directa. El G-BA aceptó esta metodología y concluyó que los resultados del CI descartaban la posibilidad de que la ganancia demostrada en la supervivencia global solo pudiera explicarse por la incertidumbre metodológica. Por lo tanto, el G-BA otorgó un indicio de un beneficio adicional no cuantificable a la sebelipasa alfa. Este es un ejemplo de la aceptación de un CI no ajustado en circunstancias excepcionales adicionales.
Figura 3. Razones para el rechazo de los CI por parte del G-BA
Llave: ACT – terapia de comparación apropiada; G-BA – Comité Conjunto Federal; CI – comparación indirecta; Resumen de las características del producto.


Conclusión
En conclusión, el análisis de los CI en el marco de las evaluaciones alemanas de AMNOG pone de relieve la complejidad y los altos estándares requeridos para dichas evaluaciones. Los estrictos criterios establecidos por el G-BA garantizan que solo se acepten CI sólidos y metodológicamente sólidos, lo que enfatiza la necesidad de enfoques metodológicos transparentes y rigurosos para garantizar la validez y confiabilidad de los resultados. Aunque solo un pequeño porcentaje de los CI son finalmente aceptados, los CI continuarán proporcionando evidencia crítica en contextos terapéuticos específicos, como las poblaciones vulnerables.
Los resultados ilustran que, en determinadas circunstancias, pueden aceptarse comparaciones ajustadas y no ajustadas, especialmente cuando las consideraciones éticas impiden los ensayos directos directos y se prioriza el tratamiento de pacientes con enfermedades raras o graves. En resumen, y desde el punto de vista de la ETS, en primer lugar es recomendable evaluar cuidadosamente la viabilidad de realizar ECA. En los casos en que un ECA no es factible, los CI son un método adecuado para compensar la falta de datos comparativos directos, pero la elección de una metodología apropiada es fundamental. Para maximizar la probabilidad de aceptación en el contexto alemán, es aconsejable adherirse estrechamente a los estrictos criterios de la G-BA.
Autores

Las evaluaciones de tecnologías sanitarias (ETS) son esenciales para determinar el valor y el impacto de los nuevos productos farmacéuticos en los sistemas sanitarios. En Alemania, el proceso AMNOG (Ley de Reorganización del Mercado Farmacéutico) exige a las empresas farmacéuticas que demuestren el beneficio médico de los medicamentos recién aprobados frente a una terapia de comparación (ACT) adecuada. Para obtener un beneficio médico adicional, los datos deben demostrar una ventaja del medicamento evaluado sobre el TCA más allá de un umbral establecido. Si bien los ensayos controlados aleatorios (ECA) son el estándar de oro para la evidencia, las comparaciones indirectas (CI) a menudo se vuelven necesarias cuando las comparaciones directas cara a cara no son factibles.
Fuentes
-
Bucher HC, Guyatt GH, Griffith LE, et al. Los resultados de las comparaciones directas e indirectas del tratamiento en el metanálisis de ensayos controlados aleatorizados. J Clin Epidemiol. 1997; 50(6):683-691. https://dx.doi.org/10.1016/s0895-4356(97)00049-8
-
Comité Conjunto Federal (G-BA). 2014. Frühe Nutzenbewertung: Beträchtlicher Zusatznutzen für Wirkstoff gegen chronische hepatitis C. Consultado el 31 de octubre de 2024. https://www.g-ba.de/presse/pressemitteilungen-meldungen/546/
-
Comité Conjunto Federal (G-BA). 2017. AM-RL-XII Elbasvir-Grazoprevir. Consultado el 31 de octubre de 2024. https://www.g-ba.de/downloads/40-268-4429/2017-06-15_AM-RL-XII_Elbasvir-Grazoprevir_D-268_TrG.pdf
-
Comité Conjunto Federal (G-BA). 2021. AM-RL-XII Sebelipasa alfa. Consultado el 31 de octubre de 2024. https://www.g-ba.de/downloads/40-268-7570/2021-06-03_AM-RL-XII_Sebelipase-alfa_D-606_TrG.pdf
-
Comité Conjunto Federal (G-BA). 2024. Base de datos de evaluaciones de beneficios. Consultado el 31 de octubre de 2024. https://www.g-ba.de/
-
Instituto para la Calidad y Eficiencia en el Cuidado de la Salud (IQWiG). 2023. Métodos Generales Versión 7.0. 19 de septiembre de 2023. https://www.iqwig.de/methoden/general-methods_version-7-0.pdf
-
Warmbold B, Scharrenbroich J, Teich K, Ingendoh-Tsakmakidis A, Löpmeier-Röh J, Kulp W. Comparaciones indirectas en las evaluaciones alemanas de AMNOG: mantener la fe. Presentado en: Congreso Europeo Anual de ISPOR; Barcelona, España; 2024.
Este artículo resume la comprensión de Cencora sobre el tema basándose en la información disponible públicamente en el momento de escribir este artículo (véanse las fuentes enumeradas) y la experiencia de los autores en esta área. Es posible que las recomendaciones proporcionadas en el artículo no sean aplicables a todas las situaciones y no constituyan asesoramiento legal; Los lectores no deben confiar en el artículo para tomar decisiones relacionadas con los temas tratados.





