Article
Naviguer dans les comparaisons indirectes dans les évaluations des technologies de la santé : Aperçu des évaluations allemandes de l’AMNOG
Dans le monde complexe de l’évaluation des technologies de la santé, les comparaisons indirectes sont souvent des ressources indispensables pour évaluer de nouveaux produits pharmaceutiques lorsqu’il n’existe pas de preuves directes. Cet article se penche sur le paysage rigoureux des évaluations AMNOG allemandes, révélant des idées et des priorités clés qui façonnent l’avenir de l’innovation dans le domaine des soins de santé.
Une première étape essentielle du processus d’ETS consiste à démontrer que la méthodologie utilisée pour générer des données comparatives par rapport à l’ACT est appropriée. Si le Comité mixte fédéral (CCF) accepte la méthodologie, toutes les données sont prises en compte dans l’évaluation des prestations supplémentaires. Cependant, si un CI n’est pas accepté, ces données ne sont pas prises en compte et l’évaluation de l’avantage supplémentaire repose uniquement sur des preuves directes.
Les critères d’acceptation des CI sont rigoureux, le succès dépendant souvent de circonstances particulières. Les limites méthodologiques, telles que l’hétérogénéité entre les études et les biais inhérents aux données probantes du côté des éléments de comparaison, peuvent introduire de l’incertitude dans les évaluations comparatives. Il est essentiel que les chercheurs et les évaluateurs s’attaquent de manière transparente à ces limites et utilisent des méthodologies robustes pour améliorer la validité et la fiabilité des résultats de l’IC. Des conseils méthodologiques concernant les exigences relatives aux CI sont fournis par l’Institut pour la qualité et l’efficacité des soins de santé (IQWiG). En outre, les développeurs de médicaments peuvent planifier une réunion de conseil supplémentaire avec le G-BA pour obtenir des informations supplémentaires sur la méthodologie appropriée. Cet article explore les résultats d’analyses récentes des CI dans les évaluations allemandes de l’AMNOG, en mettant en évidence les critères d’acceptation stricts et les implications pour divers domaines thérapeutiques.
Les critères d’acceptation des CI sont rigoureux, le succès dépendant souvent de circonstances particulières. Les limites méthodologiques, telles que l’hétérogénéité entre les études et les biais inhérents aux données probantes du côté des éléments de comparaison, peuvent introduire de l’incertitude dans les évaluations comparatives. Il est essentiel que les chercheurs et les évaluateurs s’attaquent de manière transparente à ces limites et utilisent des méthodologies robustes pour améliorer la validité et la fiabilité des résultats de l’IC. Des conseils méthodologiques concernant les exigences relatives aux CI sont fournis par l’Institut pour la qualité et l’efficacité des soins de santé (IQWiG). En outre, les développeurs de médicaments peuvent planifier une réunion de conseil supplémentaire avec le G-BA pour obtenir des informations supplémentaires sur la méthodologie appropriée. Cet article explore les résultats d’analyses récentes des CI dans les évaluations allemandes de l’AMNOG, en mettant en évidence les critères d’acceptation stricts et les implications pour divers domaines thérapeutiques.
Méthode
Une recherche systématique des CI a été effectuée à l’aide d’une base de données interne AMNOG contenant toutes les évaluations des avantages publiées sur le site Web du G-BA jusqu’en avril 2024. L’évaluation des CI par le G-BA et les prestations médicales supplémentaires associées ont été obtenues à partir de la base de données. Cette analyse exhaustive comprenait 222 évaluations des avantages complétées englobant 334 sous-populations.
Résultats
Parmi les 334 sous-populations pour lesquelles un CI a été présenté, les domaines thérapeutiques prédominants étaient l’oncologie (51,2 %), les maladies métaboliques (15,0 %) et infectieuses (11,4 %) (figure 1). Dans 22,5 % des cas, l’IC a été accepté par le G-BA (figure 2). Des lacunes méthodologiques et une similitude insuffisante des études comparées ont été les principales raisons du rejet d’un CI par le G-BA (Figure 3).
Graphique 1. Évaluation des bénéfices des CI en allemand par domaine thérapeutique
Les critères rigoureux du G-BA garantissent que seuls les circuits intégrés robustes et fiables sont acceptés. Cet accent mis sur la rigueur méthodologique est crucial pour maintenir l’intégrité des processus d’ETS. En règle générale, le G-BA nécessite des comparaisons ajustées, telles que l’IC selon Bucher. Cependant, des comparaisons ajustées et non ajustées ont été identifiées parmi les CI acceptées, tandis que d’autres méthodes, telles que les méta-analyses de réseau ou l’appariement des scores de propension, n’ont pas été jugées méthodologiquement appropriées. Par conséquent, l’analyse de la base de données a montré que les comparaisons non ajustées peuvent également être jugées acceptables dans certaines circonstances, par exemple dans les populations très vulnérables ou lorsqu’elles sont confrontées à des défis importants dans le domaine thérapeutique.
Graphique 2. Acceptation des IC par le G-BA
Par exemple, dans le cas de l’infection chronique par le virus de l’hépatite C, les combinaisons thérapeutiques contenant de l’interféron étaient définies comme ACT avant 2014. Les interférons sont associés à des effets secondaires importants, notamment la dépression et les pensées suicidaires. Compte tenu du succès thérapeutique qui peut être obtenu avec les nouveaux médicaments sofosbuvir et elbasvir/grazoprévir, ainsi que de la possibilité de raccourcir la durée du traitement et d’éviter les effets secondaires graves liés à l’interféron, il a été jugé nécessaire, pour des raisons éthiques, d’envisager des études non contrôlées à un seul bras dans lesquelles ces nouveaux médicaments ont été comparés à des témoins historiques. Par conséquent, une comparaison ajustée n’était pas possible et, en l’espèce, une comparaison non ajustée a été acceptée par l’AB-G.
Une attention particulière est également accordée aux populations très vulnérables, telles que les patients pédiatriques ou ceux atteints de maladies rares. Dans ces cas, il n’est peut-être pas éthiquement possible de mener des ECR. Dans le contexte du déficit en lipase acide lysosomale, par exemple, une maladie rare qui entraîne généralement une mortalité accrue au cours de la première année de vie sans qu’aucune alternative thérapeutique ne soit disponible au moment de l’évaluation, le fabricant a fourni aux CI des contrôles historiques pour pallier le manque de preuves comparatives directes. Le G-BA a accepté cette méthodologie et a conclu que les résultats de l’IC excluaient la possibilité que le gain démontré en termes de survie globale ne puisse s’expliquer que par une incertitude méthodologique. Par conséquent, le G-BA a accordé un indice d’un avantage supplémentaire non quantifiable à la sébélipase alfa. Il s’agit d’un exemple d’acceptation d’un CI non ajusté dans d’autres circonstances exceptionnelles.
Graphique 3. Raisons du rejet des CI par le G-BA
Graphique 1. Évaluation des bénéfices des CI en allemand par domaine thérapeutique
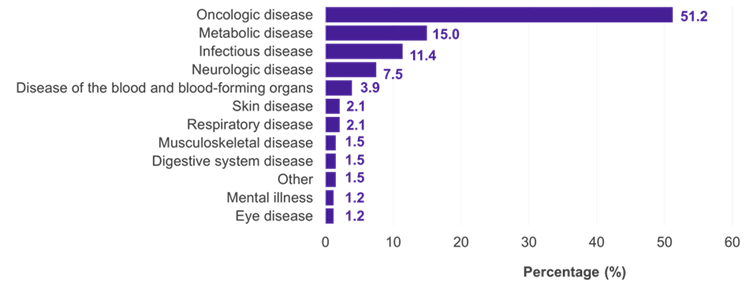
Clé: IC – comparaison indirecte.

Les critères rigoureux du G-BA garantissent que seuls les circuits intégrés robustes et fiables sont acceptés. Cet accent mis sur la rigueur méthodologique est crucial pour maintenir l’intégrité des processus d’ETS. En règle générale, le G-BA nécessite des comparaisons ajustées, telles que l’IC selon Bucher. Cependant, des comparaisons ajustées et non ajustées ont été identifiées parmi les CI acceptées, tandis que d’autres méthodes, telles que les méta-analyses de réseau ou l’appariement des scores de propension, n’ont pas été jugées méthodologiquement appropriées. Par conséquent, l’analyse de la base de données a montré que les comparaisons non ajustées peuvent également être jugées acceptables dans certaines circonstances, par exemple dans les populations très vulnérables ou lorsqu’elles sont confrontées à des défis importants dans le domaine thérapeutique.
Graphique 2. Acceptation des IC par le G-BA
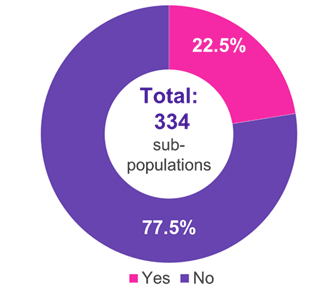
Clé: G-BA – Comité mixte fédéral ; IC – comparaison indirecte.

Par exemple, dans le cas de l’infection chronique par le virus de l’hépatite C, les combinaisons thérapeutiques contenant de l’interféron étaient définies comme ACT avant 2014. Les interférons sont associés à des effets secondaires importants, notamment la dépression et les pensées suicidaires. Compte tenu du succès thérapeutique qui peut être obtenu avec les nouveaux médicaments sofosbuvir et elbasvir/grazoprévir, ainsi que de la possibilité de raccourcir la durée du traitement et d’éviter les effets secondaires graves liés à l’interféron, il a été jugé nécessaire, pour des raisons éthiques, d’envisager des études non contrôlées à un seul bras dans lesquelles ces nouveaux médicaments ont été comparés à des témoins historiques. Par conséquent, une comparaison ajustée n’était pas possible et, en l’espèce, une comparaison non ajustée a été acceptée par l’AB-G.
Une attention particulière est également accordée aux populations très vulnérables, telles que les patients pédiatriques ou ceux atteints de maladies rares. Dans ces cas, il n’est peut-être pas éthiquement possible de mener des ECR. Dans le contexte du déficit en lipase acide lysosomale, par exemple, une maladie rare qui entraîne généralement une mortalité accrue au cours de la première année de vie sans qu’aucune alternative thérapeutique ne soit disponible au moment de l’évaluation, le fabricant a fourni aux CI des contrôles historiques pour pallier le manque de preuves comparatives directes. Le G-BA a accepté cette méthodologie et a conclu que les résultats de l’IC excluaient la possibilité que le gain démontré en termes de survie globale ne puisse s’expliquer que par une incertitude méthodologique. Par conséquent, le G-BA a accordé un indice d’un avantage supplémentaire non quantifiable à la sébélipase alfa. Il s’agit d’un exemple d’acceptation d’un CI non ajusté dans d’autres circonstances exceptionnelles.
Graphique 3. Raisons du rejet des CI par le G-BA
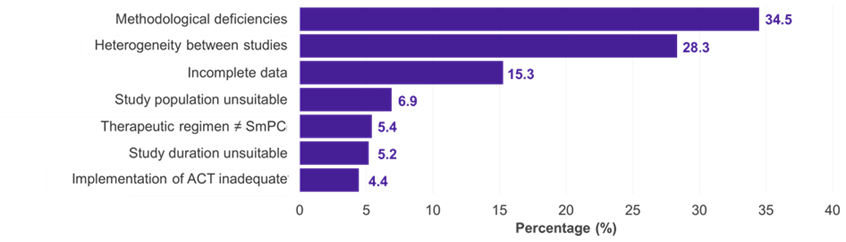
Clé: ACT – traitement de comparaison approprié ; G-BA – Comité mixte fédéral ; IC – comparaison indirecte ; RCP – résumé des caractéristiques du produit.


Conclusion
En conclusion, l’analyse des CI dans le cadre des évaluations AMNOG allemandes met en évidence la complexité et les normes élevées requises pour de telles évaluations. Les critères rigoureux fixés par le G-BA garantissent que seuls les CI robustes et méthodologiquement solides sont acceptés, ce qui souligne la nécessité d’approches méthodologiques transparentes et rigoureuses pour garantir la validité et la fiabilité des résultats. Bien que seul un faible pourcentage de CI soit finalement accepté, les CI continueront de fournir des preuves essentielles dans des contextes thérapeutiques spécifiques tels que les populations vulnérables.
Les résultats montrent que, dans certaines circonstances, des comparaisons ajustées et non ajustées peuvent être acceptées, en particulier lorsque des considérations éthiques excluent les essais directs en tête-à-tête et que le traitement des patients atteints de maladies rares ou graves est prioritaire. En résumé et du point de vue de l’ETS, il convient d’abord d’évaluer soigneusement la faisabilité de réaliser des ECR. Dans les cas où un ECR n’est pas possible, les CI sont une méthode appropriée pour compenser le manque de données comparatives directes, mais le choix d’une méthodologie appropriée est essentiel. Afin de maximiser les chances d’acceptation dans le contexte allemand, il est conseillé de respecter scrupuleusement les critères stricts de la G-BA.
Auteurs

Les évaluations des technologies de la santé (ETS) sont essentielles pour déterminer la valeur et l’impact des nouveaux produits pharmaceutiques sur les systèmes de soins de santé. En Allemagne, le processus AMNOG (Pharmaceuticals Market Reorganisation Act) exige des entreprises pharmaceutiques qu’elles démontrent le bénéfice médical des médicaments nouvellement approuvés par rapport à un traitement de comparaison approprié (ACT). Pour obtenir un bénéfice médical supplémentaire, les données doivent démontrer un avantage du médicament évalué par rapport à l’ACT au-delà d’un seuil établi. Alors que les essais contrôlés randomisés (ECR) sont l’étalon-or en matière de preuves, les comparaisons indirectes (CI) deviennent souvent nécessaires lorsque des comparaisons directes en face à face ne sont pas possibles.
Sources
-
Bucher HC, Guyatt GH, Griffith LE, et al. Les résultats des comparaisons de traitements directs et indirects dans la méta-analyse d’essais contrôlés randomisés. J Clin Epidemiol. 1997; 50(6):683-691. https://dx.doi.org/10.1016/s0895-4356(97)00049-8
-
Comité mixte fédéral (BA-G). 2014. Frühe Nutzenbewertung : Beträchtlicher Zusatznutzen für Wirkstoff gegen chronische hepatitis C. Consulté le 31 octobre 2024. https://www.g-ba.de/presse/pressemitteilungen-meldungen/546/
-
Comité mixte fédéral (BA-G). 2017. AM-RL-XII Elbasvir-Grazoprévir. Consulté le 31 octobre 2024. https://www.g-ba.de/downloads/40-268-4429/2017-06-15_AM-RL-XII_Elbasvir-Grazoprevir_D-268_TrG.pdf
-
Comité mixte fédéral (BA-G). 2021. AM-RL-XII Sebelipase alfa. Consulté le 31 octobre 2024. https://www.g-ba.de/downloads/40-268-7570/2021-06-03_AM-RL-XII_Sebelipase-alfa_D-606_TrG.pdf
-
Comité mixte fédéral (BA-G). 2024. Base de données d’évaluation des prestations. Consulté le 31 octobre 2024. https://www.g-ba.de/
-
Institut pour la qualité et l’efficacité des soins de santé (IQWiG). 2023. Méthodes générales version 7.0. 19 septembre 2023. https://www.iqwig.de/methoden/general-methods_version-7-0.pdf
-
Warmbold B, Scharrenbroich J, Teich K, Ingendoh-Tsakmakidis A, Löpmeier-Röh J, Kulp W. Comparaisons indirectes dans les évaluations allemandes de l’AMNOG : gardez la foi. Présenté à : Congrès européen annuel de l’ISPOR ; Barcelone, Espagne ; 2024.
Cet article résume la compréhension du sujet par Cencora sur la base d’informations accessibles au public au moment de la rédaction (voir les sources énumérées) et de l’expertise des auteurs dans ce domaine. Les recommandations formulées dans l’article peuvent ne pas s’appliquer à toutes les situations et ne constituent pas des conseils juridiques. Les lecteurs ne doivent pas se fier à l’article pour prendre des décisions liées aux sujets abordés.





