Ortak Klinik Değerlendirmenin başlamasına çok az kaldı: PICO kaygısı gerçeğe mi dönüşecek?

Hazır mısın?
Yeni Gelişmeler
Tıbbi ürünlerin bilimsel özellikleri
Yeni aktif madde |
Aşağıdaki özelliklere sahip yeni bir kimyasal, biyolojik veya radyofarmasötik aktif madde:
|
Kanser tedavisi |
|
ATMP'nin Tanıtımı |
|
Anahtar: ATMP – gelişmiş tedavi tıbbi ürünü; EC – Avrupa Komisyonu; AB – Avrupa Birliği; HTACG – Sağlık Teknolojisi Değerlendirme Koordinasyon Grubu; ICD-O - Onkoloji için Uluslararası Hastalık Sınıflandırması; JCA – Ortak Klinik Değerlendirme.
Öne çıkan uygulama eylemleri ve kılavuz belgeler
Uygulama yasası |
Son |
Durum |
|
Tıbbi ürünlerin JCA'sı için usul kuralları |
1. Çeyrek–2. Çeyrek 2024 |
Kabul tarihi: 23 Mayıs 2024 |
|
EMA ile bilgi alışverişi yoluyla işbirliğine ilişkin kurallar |
3. Çeyrek 2024 |
Kabul tarihi: 18 Ekim 2024 |
|
Çıkar çatışması yönetimi için usul kuralları |
3. Çeyrek 2024 |
Kabul tarihi: 25 Ekim 2024 |
|
Tıbbi ürünlerin JSC'si için usul kuralları |
3. Çeyrek 2024 |
Son versiyon hazırlanıyor, halkın katılımı kapatıldı |
|
Tıbbi cihazların ve IVD tıbbi cihazların JSC'si için prosedür kuralları |
4. Çeyrek 2024 |
Halkın katılımı 26 Kasım 2024'e kadar açık |
|
Tıbbi cihazların ve IVD tıbbi cihazların JCA'sı için prosedür kuralları |
4. Çeyrek 2024 |
Planlanmış |
Anahtar: EMA – Avrupa İlaç Ajansı; IVD – in vitro tanı; JCA – Ortak Klinik Değerlendirme; JSC – Ortak Bilimsel Danışma.
Ek olarak, şu anda 10'dan fazla kılavuz belge hazırlanmaktadır ve JCA'nın yürürlüğe girmesinden önce yayınlanması beklenmektedir. Bunlar arasında, kapsam belirleme süreci için bilimsel metodolojiyi tanımlayan kılavuz, JCA kapsamı için PICO'nun (nüfus, müdahale, karşılaştırıcı, sonuç) tanımı gibi JCA sürecinin bu 'ilk adımının' nasıl yürütüleceğine ilişkin EUnetHTA 21'in önceki ön kılavuzunu tamamlaması beklendiğinden, paydaşlar tarafından özellikle merakla beklenmektedir.
Sağlık teknolojisi geliştiricisi tarafından JCA sürecinin başlatılması

PICO tanımı
Tablo 3. EUnetHTA 21 ve Cencora ile mCRPC'deki PICO simülasyonlarının karşılaştırılması
|
|
EUnetHTA 21 |
Cencora Belediyesi |
|
Göstergesi |
Androjen reseptörü (AR) yolu inhibisyonu ve taksan bazlı kemoterapi ile tedavi edilen prostat spesifik membran antijeni (PSMA) pozitif metastatik kastrasyona dirençli prostat kanseri (mCRPC) olan yetişkin hastalar |
|
|
Kapsanan Üye Devlet sayısı |
8 (Ülkeler belirtilmedi) |
16 (Belçika, Çek Cumhuriyeti, Danimarka, Finlandiya, Fransa, Almanya, Yunanistan, İrlanda, İtalya, Lüksemburg, Hollanda, Norveç, Polonya, Portekiz, İspanya ve İsveç) |
|
Sonuçlar (hayır) |
|
|
|
Nüfus |
Tam lisanslı nüfus + 4 alt popülasyon |
Tam lisanslı nüfus + 4 alt popülasyon |
|
Müdahale |
Pluvicto Belediyesi |
Cenpicomab Belediyesi |
|
Karşılaştırıcılar |
6 |
12 |
|
Sonuç -ları |
21 |
20 (bkz. Şekil 1) |
|
Konsolide PICO'lar |
Tam lisanslı nüfus için 2'si dahil olmak üzere 6 |
Tam lisanslı nüfus için 9 dahil olmak üzere 18 (bakınız Tablo 4) |
|
PICO anketinin tarihi |
Kasım 2022 |
Nisan 2024 |
Anahtar: hayır. –sayı; PICO – nüfus, müdahale, karşılaştırıcı, sonuç.
Her iki simülasyonun karşılaştırılması, daha geniş bir Üye Devlet yelpazesinin dahil edilmesinin ve en son onaylanan karşılaştırıcıları yakalamak için zaman çizelgesinin genişletilmesinin, klinik kılavuzlardaki, tedavi standartlarındaki ve AB ülkeleri genelinde yeni ilaçların pazara erişim hızındaki farklılıklar nedeniyle JCA kapsamı için dikkate alınması gereken konsolide PICO'larda önemli bir artışa yol açabileceğini göstermektedir.
Karşılaştırıcılar
EUnetHTA 21'in pratik kılavuzuna göre, dahil edilen ülkelerde gerekli olan her karşılaştırıcı, değerlendirme kapsamı için ayrı bir PICO ile sonuçlanır. Bu pratik kılavuzun ardından, Cencora'nın analizi, 16 ülkeden beşinin (Almanya, İrlanda, İtalya, Portekiz ve İspanya) İtalya'daki iki karşılaştırıcıdan Portekiz'deki yedi karşılaştırıcıya kadar bir aralığı kapsayan, yerel olarak ilgili tüm karşılaştırıcıları klinik değerlendirmeye dahil etme gerekliliği nedeniyle tüm popülasyon için PICO'larda yüksek bir sayıya yol açtı. Buna karşılık, üç ülke (Çek Cumhuriyeti, Fransa ve Hollanda) yerel olarak ilgili bir karşılaştırıcıya göre değerlendirmenin yeterli olduğunu, başka bir ülke (Polonya) ilgili karşılaştırıcının en yüksek pazar payına göre seçileceğini belirtmiş ve beş ülke (Belçika, Danimarka, Finlandiya, Norveç ve İsveç) ilgili arıtma seçeneğinin ürünün (yani işlem hattının) HTD tarafından konumlandırılmasına bağlı olacağını vurgulamıştır. Lüksemburg'da değerlendirme, resmi 'pays de provenance'da (yani menşe ülke, genellikle Belçika) sunulan dosyaya dayanmaktadır. Yunanistan'da, değerlendirme kapsamı için yalnızca bir karşılaştırıcının ilgili olduğu düşünülmüştür. Tablo 4, tüm cenpicomab popülasyonu için tanımlanan PICO'ları göstermektedir.
EUnetHTA 21 analizi için, bireysel ülke yanıtlarının HTD'lere sunulmayacağı JCA çerçevesindeki kapsam belirleme sürecini yansıtan ülkeye özgü gereklilikler yayınlanmamıştır.
|
|
cenpicomab için tüm popülasyon için ilgilenilen karşılaştırıcılar |
Her bir karşılaştırıcıyı talep eden ülkeler |
PICO 1 |
Abirateron + prednizon / prednizolon |
BE, DE, FI, FR, IE, LU, NL, HAYIR, PT, SE |
PICO 2 Serisi |
En iyi destekleyici bakım* |
DE,DK, ES, FI, IE, NL, HAYIR, SE |
PICO 3 Serisi |
Kabazitaksel + prednizon/prednizolon* |
BE, DE,DK, ES,FI, IE, IT , LU, NL, NO, PT, SE |
PICO 4 Serisi |
Dosetaksel + prednizon/prednizolon* |
BE, DK, FI, IE, LU, NL, HAYIR, PT, SE |
PICO 5 Serisi |
Enzalutamid |
BE, DE, DK, FI, FR, IE, LU, NL, NO, PT, SE |
PICO 6 Serisi |
Lutesyum (177Lu) vipivotid tetraksetan + androjen yoksunluğu tedavisi* |
BE, DE, FI, GR, IE, IT, NL, PO, PT |
PICO 7 Serisi |
Olaparib* |
DK, PT |
PICO 8 Serisi |
Radyum-223* |
ES, FI, PO |
PICO 9 Serisi |
Radyum-223 + luteinize edici hormon salgılatıcı hormon analoğu* |
PO, PT |
Anahtar: BE – Belçika; CZ – Çek Cumhuriyeti; DE – Almanya; DK – Danimarka; ES – İspanya; FI – Finlandiya; Fransa – Fransa; GR – Yunanistan; IE – İrlanda; BT – İtalya; LU – Lüksemburg; NL – Hollanda; HAYIR – Norveç; PICO – nüfus, müdahale, karşılaştırıcı, sonuç; PO – Polonya; PT – Portekiz; SE – İsveç.
Not: Kalın harflerle yazılan ülkeler, tanımlanan tüm karşılaştırıcılara yönelik veri talebi nedeniyle PICO'nun türetildiği ülkeleri temsil eder.
*Karşılaştırıcılar, alt popülasyonlar için PICO'larda da dikkate alınır (burada sunulmamıştır).
Kapsam belirleme aşamasından kaynaklanan kapsamlı PICO'ların olasılığı, yetim ve ATMP dahil olmak üzere üç yetkili onkoloji tedavisi için yakın tarihli bir EFPIA simülasyonunda doğrulandı ve bu da konsolidasyondan sonra yedi ila 23 PICO arasında değişen yedi ülkede çok sayıda potansiyel PICO ile sonuçlandı.
Sonuç -ları
Şekil 1. Belirtilen klinik sonuçlara göre veri talep eden ülke sayısı
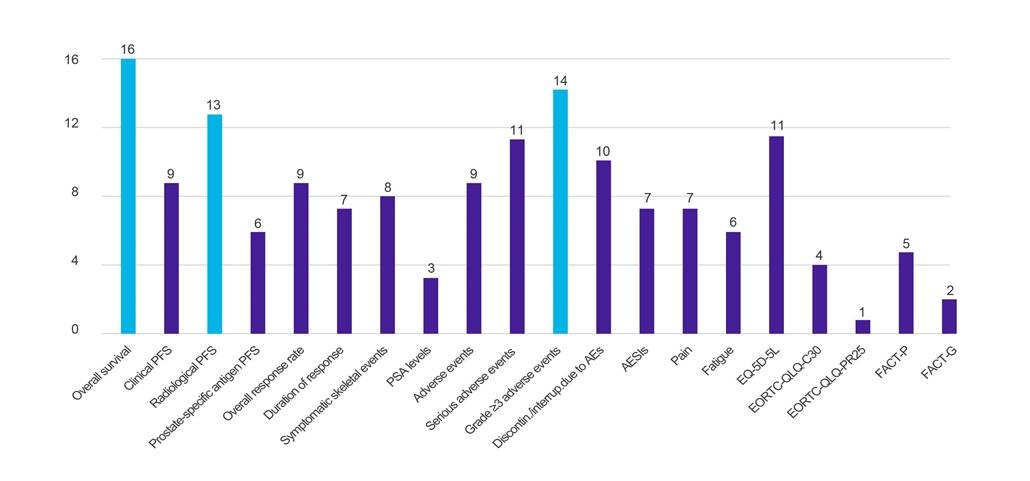
Anahtar: AE – advers olay; AESI – özel ilgi çekici advers olay; EORTC-QLQ-C30 – Avrupa Kanser Araştırma ve Tedavi Örgütü Yaşam Kalitesi Anketi (-Çekirdek, 30 madde); EORTC-QLQ-PR25 – Avrupa Kanser Araştırma ve Tedavi Örgütü Yaşam Kalitesi Anketi (-Prostat, 25 madde); EQ-5D-5L – EuroQol-5 Boyut-5 Seviyesi; FACT-G – Kanser Tedavisinin Fonksiyonel Değerlendirmesi-Genel; FACT-P – Kanser Tedavisinin Fonksiyonel Değerlendirmesi-Prostat; PFS – progresyonsuz sağkalım; PSA – prostat spesifik antijen.
Sonuç

JCA'nın yürürlüğe girmesine iki aydan az bir süre kala ve metodolojik rehberlik hala beklemedeyken, JCA'nın temelini oluşturan kapsam belirleme sürecine ilişkin hem endüstri hem de HTA organları için önemli belirsizlikler devam etmektedir. HTACG tarafından düzenlenen ve çeşitli STD organlarını içeren PICO tatbikatlarının yanı sıra HTD'ler tarafından yürütülen PICO simülasyonları, yetenek ve iç strateji açısından kilit paydaşları yaklaşmakta olan JCA'ya hazırlamak için çok önemlidir. Bununla birlikte, bu simülasyonların gerçek JCA'ya nasıl dönüşeceği ve değerlendirmenin yerel pazar erişimi üzerinde ne gibi bir etkisi olacağı henüz belli değil. AB HTA, ilk JCA'lar sırasında bir öğrenme sistemi olarak işlev görecek ve verimli bir sistem oluşturmak için tüm paydaşların işbirliği, çaba ve geri bildirimi gerekli olacaktır.
Kaynak
-
EUnetHTA 21. Pratik Kılavuz. D4.2 Kapsam belirleme süreci. Sürüm 1.0. 2022. Erişim tarihi: 23 Eylül 2024. https://www.eunethta.eu/wp-content/uploads/2022/09/EUnetHTA-21-D4.2-practical-guideline-on-scoping-process-v1.0.pdf
-
EUnetHTA 21. Konsolide PICO. PICO egzersizi I – Pluvicto. Sürüm 1.0. 2023. Erişim tarihi: 23 Eylül 2024. https://www.eunethta.eu/wp-content/uploads/2023/09/EUnetHTA-21-PICO-1-Deliverbale-1.pdf
-
Avrupa Komisyonu. Avrupa Parlamentosu ve Konseyi'nin 15 Aralık 2021 tarihli ve (EC) 2021/2282 sayılı Sağlık Teknolojisi Değerlendirmesi ve 2011/24/EU sayılı Direktifte Değişiklik Yapılmasına İlişkin Tüzüğü. 2021. Erişim tarihi: 23 Eylül 2024. https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32021R2282
-
Avrupa Komisyonu. Teoriden pratiğe: AB Sağlık Teknolojisi Değerlendirme Yönetmeliğini uygulamak. 2023. Erişim tarihi: 11 Mayıs 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-05-11_en
-
Avrupa Komisyonu. Teoriden pratiğe: AB Sağlık Teknolojisi Değerlendirme Yönetmeliğini uygulamak. 2023. Erişim tarihi: 18 Eylül 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-09-18_en
-
Avrupa Komisyonu. Teoriden pratiğe: AB Sağlık Teknolojisi Değerlendirme Yönetmeliğini uygulamak. 2023. Erişim tarihi: 22 Kasım 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-11-22_en
-
Avrupa Komisyonu. Teoriden pratiğe: AB Sağlık Teknolojisi Değerlendirme Yönetmeliğini uygulamak. 2024. Erişim tarihi: 30 Ocak 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-01-30_en
-
Avrupa Komisyonu. Teoriden pratiğe: AB Sağlık Teknolojisi Değerlendirme Yönetmeliğini uygulamak. 2024. Erişim tarihi: 9 Nisan 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-04-09_en
-
Avrupa Komisyonu. Teoriden pratiğe: AB Sağlık Teknolojisi Değerlendirme Yönetmeliğini uygulamak. 2024. Erişim tarihi: 23 Eylül 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-09-06_en
-
Avrupa Komisyonu. Uygulama haddeleme planı 2023-2024. Eylül 2024'te güncellendi. Erişim tarihi: 23 Eylül 2024. https://health.ec.europa.eu/document/download/397b2a2e-1793-48fd-b9f5-7b8f0b05c7dd_en
-
Avrupa Komisyonu. Sağlık teknolojisi değerlendirmesi – tıbbi cihazların ortak klinik değerlendirmeleri. 2024. Erişim tarihi: 5 Kasım 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13707-Health-technology-assessment-joint-clinical-assessments-of-medical-devices_en
-
Avrupa Komisyonu. Sağlık teknolojisi değerlendirmesi – tıbbi ürünlerin ortak klinik değerlendirmeleri. 2024. Erişim tarihi: 24 Eylül 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13708-Health-technology-assessment-joint-clinical-assessments-of-medicinal-products_en
-
Avrupa Komisyonu. Sağlık teknolojisi değerlendirmesi – çıkar çatışmalarını değerlendirmek ve yönetmek için prosedür kuralları. 2024. Erişim tarihi: 23 Eylül 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13751-Health-technology-assessment-procedural-rules-for-assessing-and-managing-conflicts-of-interest_en
-
Avrupa Komisyonu. Sağlık teknolojisi değerlendirmesi – Avrupa İlaç Ajansı ile işbirliği. 2024. Erişim tarihi: 23 Eylül 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/14164-Health-technology-assessment-cooperation-with-the-European-Medicines-Agency_en
-
Avrupa Komisyonu. Sağlık teknolojisi değerlendirmesi – tıbbi cihazlar ve in vitro diagnostik tıbbi cihazlar hakkında ortak bilimsel danışmanlıklar. 2024. Erişim tarihi: 5 Kasım 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13752-Health-technology-assessment-joint-scientific-consultations-on-medical-devices-in-vitro-diagnostic-medical-devices_en
-
Avrupa Komisyonu. Sağlık teknolojisi değerlendirmesi – beşeri tıbbi ürünler hakkında ortak bilimsel istişareler. 2024. Erişim tarihi: 22 Ekim 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13759-Health-technology-assessment-Joint-scientific-consultations-on-medicinal-products-for-human-use_en
-
Avrupa Komisyonu. Tıbbi ürünlerin ortak klinik değerlendirmesi: sağlık teknolojisi geliştiricileri tarafından erken bilgilerin sunulması. 2024. Erişim tarihi: 23 Eylül 2024. https://health.ec.europa.eu/document/download/77476507-9ddc-47e3-ae0d-11c05f89169c_en?filename=hta_%20mp-jca_htd_en.pdf
-
Avrupa İlaç Endüstrileri ve Dernekleri Federasyonu. Onkoloji ilaçları için AB HTA Yönetmeliği: Önerilen EUnetHTA21 yöntemlerinin etkisine ilişkin bir simülasyondan öğrenilenler. 2024. Erişim tarihi: 23 Eylül 2024. https://www.efpia.eu/media/qrjah2ij/efpia-evidera-research-on-eunethta21-methods.pdf
-
Avrupa İlaç Ajansı. İleri tedavi tıbbi ürünleri: Genel bakış. 2024. Erişim tarihi: 23 Eylül 2024. https://www.ema.europa.eu/en/human-regulatory-overview/advanced-therapy-medicinal-products-overview
-
HTACG'yi seçin. Ortak klinik değerlendirmelere tabi tıbbi ürünlerin bilimsel özellikleri. 2024. Erişim tarihi: 23 Eylül 2024. https://health.ec.europa.eu/document/download/48974c78-1c37-4cf9-9fc9-a630fee9baac_en?filename=hta_mp_jca_sc-specifications_en.pdf
-
O'Donnell R. PICO kaygısından PICO stratejisine: AB HTA başarısı için planlama. 2024. Erişim tarihi: 23 Eylül 2024. https://www.amerisourcebergen.com/insights/manufacturers/from-pico-anxiety-to-pico-strategy




