Not long until the Joint Clinical Assessment begins: Will PICO anxiety become a reality?

Er du klar?
Den siste utviklingen
Vitenskapelige spesifikasjoner for legemidler
Nytt virkestoff |
Et nytt kjemisk, biologisk eller radiofarmasøytisk virkestoff som:
|
Kreftbehandling |
|
ATMP |
|
Nøkkel: ATMP – legemiddel for avansert terapi; EC – EU-kommisjonen; EU – Den europeiske union; HTACG – Koordineringsgruppe for medisinsk teknologivurdering; ICD-O – Internasjonal klassifisering av sykdommer for onkologi; JCA – Felles klinisk vurdering.
Utestående gjennomføringslover og veiledningsdokumenter
Gjennomføringslov |
Frist |
Status |
|
Prosedyreregler for JCA av legemidler |
1.–2. kvartal 2024 |
Vedtatt 23 mai 2024 |
|
Regler for samarbeid gjennom informasjonsutveksling med EMA |
3. kvartal 2024 |
Vedtatt 18 oktober 2024 |
|
Prosedyreregler for håndtering av interessekonflikter |
3. kvartal 2024 |
Vedtatt 25 oktober 2024 |
|
Prosedyreregler for JSC av legemidler |
3. kvartal 2024 |
Endelig versjon under utarbeidelse, offentlig høring avsluttet |
|
Prosedyreregler for JSC av medisinsk utstyr og IVD medisinsk utstyr |
4. kvartal 2024 |
Offentlig høring åpen til 26 november 2024 |
|
Prosedyreregler for JCA for medisinsk utstyr og IVD medisinsk utstyr |
4. kvartal 2024 |
Planlagt |
Nøkkel: EMA – Det europeiske legemiddelbyrået; IVD – in vitro diagnostisk; JCA – Felles klinisk vurdering; JSC – Felles vitenskapelig konsultasjon.
I tillegg er mer enn 10 veiledningsdokumenter under utarbeidelse og skal publiseres før JCA trer i kraft. Blant disse er veiledningen som beskriver den vitenskapelige metodikken for kartleggingsprosessen spesielt etterlengtet av interessenter, siden den forventes å utfylle tidligere foreløpig veiledning fra EUnetHTA 21 om hvordan dette "første trinnet" i JCA-prosessen, for eksempel definisjonen av PICO (populasjon, intervensjon, komparator, utfall) for JCA-omfanget, vil bli gjennomført.
Oppstart av JCA-prosessen av helseteknologiutvikleren

PICO-definisjon
Tabell 3. Sammenligning av PICO-simuleringer i mCRPC av EUnetHTA 21 og Cencora
|
|
EUnetHTA 21 |
Cencora |
|
Indikasjon |
Voksne pasienter med progressiv prostataspesifikt membranantigen (PSMA)-positiv metastatisk kastrasjonsresistent prostatakreft (mCRPC) som har blitt behandlet med androgenreseptorveishemming (AR) og taksanbasert kjemoterapi |
|
|
Antall medlemsstater som dekkes |
8 (Land ikke spesifisert) |
16 (Belgia, Tsjekkia, Danmark, Finland, Frankrike, Tyskland, Hellas, Irland, Italia, Luxembourg, Nederland, Norge, Polen, Portugal, Spania og Sverige) |
|
Resultater (nr.) |
|
|
|
Befolkninger |
Full lisensiert befolkning + 4 underpopulasjoner |
Full lisensiert befolkning + 4 underpopulasjoner |
|
Intervensjon |
Pluvicto |
Cenpicomab |
|
Komparatorer |
6 |
12 |
|
Resultater |
21 |
20 (Se Figur 1) |
|
Konsoliderte PICO-er |
6, inkludert 2 for hele lisensierte populasjon |
18, inkludert 9 for hele lisensierte populasjon (se tabell 4) |
|
Dato for PICO-spørreundersøkelsen |
november 2022 |
Mai 2024 |
Nøkkel: nei. –nummer; PICO – populasjon, intervensjon, komparator, utfall.
Sammenligningen av begge simuleringene viser at det å inkludere et bredere spekter av medlemsstater og utvide tidslinjen for å fange opp de sist godkjente komparatorene kan føre til en betydelig økning i konsoliderte PICO-er som skal vurderes for JCA-omfanget på grunn av variasjoner i kliniske retningslinjer, behandlingsstandarder og rask markedstilgang for nye legemidler i EU-landene.
Komparatorer
I henhold til EUnetHTA 21s praktiske retningslinjer resulterer alle nødvendige komparatorer på tvers av de inkluderte landene i en egen PICO for vurderingsomfanget. Etter denne praktiske retningslinjen førte Cencoras analyse til et høyt antall PICO-er for hele befolkningen, drevet av kravet fra fem av de 16 landene (Tyskland, Irland, Italia, Portugal og Spania) om å inkludere alle lokalt relevante komparatorer i den kliniske vurderingen, som dekker et område fra to komparatorer i Italia til syv komparatorer i Portugal. Derimot uttalte tre land (Den tsjekkiske republikk, Frankrike og Nederland) at vurdering mot ett lokalt relevant komparatorobjekt var tilstrekkelig, et annet land (Polen) oppga at det aktuelle komparatoret ville bli valgt basert på den høyeste markedsandelen, og fem land (Belgia, Danmark, Finland, Norge og Sverige) fremhevet at det aktuelle behandlingsalternativet ville avhenge av posisjoneringen av produktet (dvs. behandlingslinjen) ved HTD. I Luxembourg er vurderingen basert på dossieret som er sendt inn i den offisielle "pays de provenance" (dvs. opprinnelsesland, vanligvis Belgia). I Hellas ble kun én komparator vurdert som relevant for vurderingsomfanget. Tabell 4 viser identifiserte PICOer for hele populasjonen av cenpicomab.
For EUnetHTA 21-analysen er det ikke publisert landsspesifikke krav, noe som gjenspeiler omfangsprosessen innenfor rammen av JCA, der individuelle lands svar ikke vil bli gjort tilgjengelig for HTD-er.
|
|
Komparatorer av interesse for hele populasjonen for cenpicomab |
Land som ber om hver sammenligningsfaktor |
PICO 1 |
Abirateron + prednison/prednisolon |
BE, DE, FI, FR, IE, LU, NL, NO, PT, SE |
PICO 2 |
Beste støttende behandling* |
DE, DK, ES, FI, IE, NL, NO, SE |
PICO 3 |
Cabazitaxel + prednison/prednisolon* |
BE, DE, DK, ES, FI, IE, IT, LU, NL, NO, PT, SE |
PICO 4 |
Docetaksel + prednison/prednisolon* |
BE, DK, FI, IE, LU, NL, NO, PT, SE |
PICO 5 |
Enzalutamid |
BE, DE,DK, FI, FR, IE, LU, NL, NO, PT, SE |
PICO 6 |
Lutetium (177Lu) vipivotid tetraksetan + androgen deprivasjonsterapi* |
BE, DE, FI, GR, IE, IT, NL, PO, PT |
PICO 7 |
Olaparib* |
DK, PT |
PICO 8 |
Radium-223* |
ES, FI, PO |
PICO 9 |
Radium-223 + luteiniserende hormonfrigivende hormonanalog* |
PO, PT |
Nøkkel: BE – Belgia; CZ – Tsjekkia; DE – Tyskland; DK – Danmark; ES – Spania; FI – Finland; FR – Frankrike; GR – Hellas; IE – Irland; IT – Italia; LU – Luxembourg; NL – Nederland; NEI – Norge; PICO – populasjon, intervensjon, komparator, utfall; PO – Polen; PT – Portugal; SE – Sverige.
Merk: Land i fet skrift representerer landene PICO ble avledet fra på grunn av forespørselen om data mot alle identifiserte komparatorer.
*Komparatorer også vurdert i PICOer for underpopulasjoner (ikke presentert her).
Muligheten for omfattende PICO-er som følge av omfangsfasen ble bekreftet i en nylig EFPIA-simulering for tre godkjente onkologiske behandlinger, inkludert orphan og ATMP, noe som resulterte i et stort antall potensielle PICO-er i syv land, fra syv til 23 PICO-er etter konsolidering.
Resultater
Figur 1. Antall land som ber om data mot spesifiserte kliniske utfall
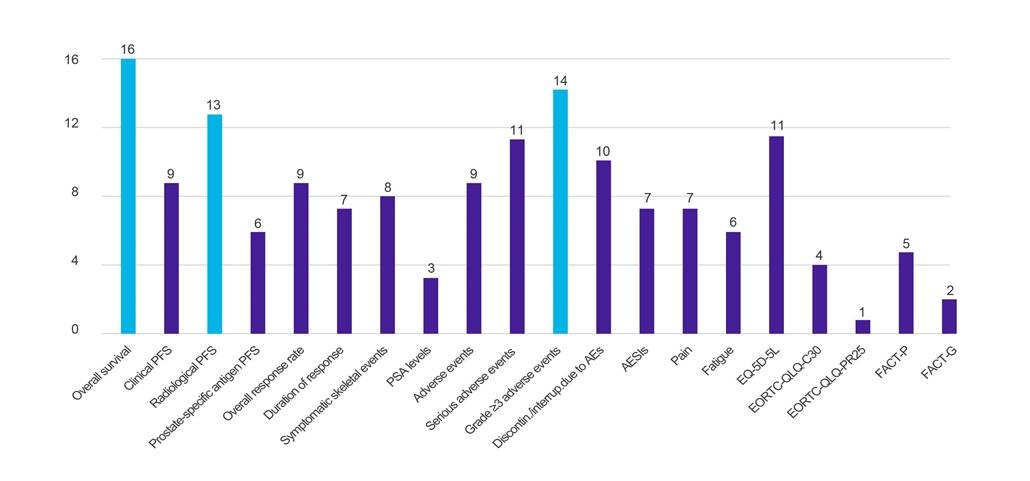
Nøkkel: AE – uønsket hendelse; AESI – uønsket hendelse av spesiell interesse; EORTC-QLQ-C30 – Den europeiske organisasjonen for forskning og behandling av kreft Quality of Life Questionnaire (-kjerne, 30-element); EORTC-QLQ-PR25 – Den europeiske organisasjonen for forskning og behandling av kreft Quality of Life Questionnaire (-Prostata, 25-element); EQ-5D-5L – EuroQol-5 dimensjon-5 nivå; FACT-G – Funksjonell vurdering av kreftterapi - generelt; FACT-P – Funksjonell vurdering av kreftterapi-prostata; PFS – progresjonsfri overlevelse; PSA – prostataspesifikt antigen.
Konklusjoner

Med mindre enn to måneder igjen til JCA trer i kraft, og med metodisk veiledning som fortsatt er under behandling, er det fortsatt betydelig usikkerhet for både bransjen og HTA-organene når det gjelder avgrensningsprosessen, som danner grunnlaget for JCA. PICO-øvelser organisert av HTACG og involverer ulike HTA-organer, samt PICO-simuleringer utført av HTD-er, er avgjørende for å forberede viktige interessenter for den kommende JCA når det gjelder kapasitet og intern strategi. Det gjenstår imidlertid å se hvordan disse simuleringene vil oversettes til selve JCA og hvilken innvirkning vurderingen vil ha på lokal markedstilgang. EUs metodevurdering vil fungere som et læringssystem under de første JCA-ene, og samarbeid, innsats og tilbakemeldinger fra alle interessenter vil være avgjørende for å skape et effektivt system.
Kilder
-
EUnetHTA 21. Praktisk retningslinje. D4.2 Omfangsprosess. Versjon 1.0. 2022. Åpnet 23 september 2024. https://www.eunethta.eu/wp-content/uploads/2022/09/EUnetHTA-21-D4.2-practical-guideline-on-scoping-process-v1.0.pdf
-
EUnetHTA 21. Konsolidert PICO. PICO-øvelse I – Pluvicto. Versjon 1.0. 2023. Åpnet 23 september 2024. https://www.eunethta.eu/wp-content/uploads/2023/09/EUnetHTA-21-PICO-1-Deliverbale-1.pdf
-
Europakommisjonen. Europaparlamentets og rådets forordning (EF) 2021/2282 av 15. desember 2021 om vurdering av medisinsk teknologi og om endring av direktiv 2011/24/EU. 2021. Åpnet 23 september 2024. https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32021R2282
-
Europakommisjonen. Fra teori til praksis: implementering av EUs forordning om medisinsk teknologivurdering. 2023. Åpnet 11 mai 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-05-11_en
-
Europakommisjonen. Fra teori til praksis: implementering av EUs forordning om medisinsk teknologivurdering. 2023. Åpnet 18 september 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-09-18_en
-
Europakommisjonen. Fra teori til praksis: implementering av EUs forordning om medisinsk teknologivurdering. 2023. Åpnet 22 november 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-11-22_en
-
Europakommisjonen. Fra teori til praksis: implementering av EUs forordning om medisinsk teknologivurdering. 2024. Åpnet 30 januar 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-01-30_en
-
Europakommisjonen. Fra teori til praksis: implementering av EUs forordning om medisinsk teknologivurdering. 2024. Åpnet 9. april 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-04-09_en
-
Europakommisjonen. Fra teori til praksis: implementering av EUs forordning om medisinsk teknologivurdering. 2024. Åpnet 23 september 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-09-06_en
-
Europakommisjonen. Rullerende gjennomføringsplan 2023-2024. Oppdatert september 2024. Åpnet 23 september 2024. https://health.ec.europa.eu/document/download/397b2a2e-1793-48fd-b9f5-7b8f0b05c7dd_en
-
Europakommisjonen. Metodevurdering – felles kliniske vurderinger av medisinsk utstyr. 2024. Åpnet 5. november 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13707-Health-technology-assessment-joint-clinical-assessments-of-medical-devices_en
-
Europakommisjonen. Metodevurdering – felles kliniske vurderinger av legemidler. 2024. Åpnet 24 september 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13708-Health-technology-assessment-joint-clinical-assessments-of-medicinal-products_en
-
Europakommisjonen. Metodevurdering – prosedyreregler for vurdering og håndtering av interessekonflikter. 2024. Åpnet 23 september 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13751-Health-technology-assessment-procedural-rules-for-assessing-and-managing-conflicts-of-interest_en
-
Europakommisjonen. Metodevurdering – samarbeid med Det europeiske legemiddelkontoret (The European Medicines Agency). 2024. Åpnet 23 september 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/14164-Health-technology-assessment-cooperation-with-the-European-Medicines-Agency_en
-
Europakommisjonen. Metodevurdering – felles vitenskapelige konsultasjoner om medisinsk utstyr og medisinsk utstyr for in vitro-diagnostikk. 2024. Åpnet 5. november 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13752-Health-technology-assessment-joint-scientific-consultations-on-medical-devices-in-vitro-diagnostic-medical-devices_en
-
Europakommisjonen. Metodevurdering – felles vitenskapelige konsultasjoner om humane legemidler. 2024. Åpnet 22 oktober 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13759-Health-technology-assessment-Joint-scientific-consultations-on-medicinal-products-for-human-use_en
-
Europakommisjonen. Felles klinisk vurdering av legemidler: innlevering av tidlig informasjon fra utviklere av medisinsk teknologi. 2024. Åpnet 23 september 2024. https://health.ec.europa.eu/document/download/77476507-9ddc-47e3-ae0d-11c05f89169c_en?filename=hta_%20mp-jca_htd_en.pdf
-
European Federation of Pharmaceutical Industries and Associations. EUs HTA-forordning for onkologiske legemidler: Læring fra en simulering av effekten av foreslåtte EUnetHTA21-metoder. 2024. Åpnet 23 september 2024. https://www.efpia.eu/media/qrjah2ij/efpia-evidera-research-on-eunethta21-methods.pdf
-
Det europeiske legemiddelkontoret (The European Medicines Agency). Legemidler for avansert terapi: Oversikt. 2024. Åpnet 23 september 2024. https://www.ema.europa.eu/en/human-regulatory-overview/advanced-therapy-medicinal-products-overview
-
HTACG. Vitenskapelige spesifikasjoner av legemidler som er gjenstand for felles kliniske vurderinger. 2024. Åpnet 23 september 2024. https://health.ec.europa.eu/document/download/48974c78-1c37-4cf9-9fc9-a630fee9baac_en?filename=hta_mp_jca_sc-specifications_en.pdf
-
O'Donnell R. Fra PICO-angst til PICO-strategi: planlegging for EUs HTA-suksess. 2024. Åpnet 23 september 2024. https://www.amerisourcebergen.com/insights/manufacturers/from-pico-anxiety-to-pico-strategy




