Do zahájení společného klinického hodnocení už nezbývá moc času: Stane se úzkost spojená s PICO skutečností?

Můžeš?
Nedávný vývoj
Vědecké specifikace léčivých přípravků
Nová účinná látka |
Nová chemická, biologická nebo radiofarmaceutická účinná látka, která:
|
Léčba rakoviny |
|
ATMP (Zkratka pro plánování let |
|
Klíč: ATMP – léčivý přípravek pro moderní terapii; ES – Evropská komise; EU – Evropská unie; HTACG – Koordinační skupina pro hodnocení zdravotnických technologií; MKN-O – Mezinárodní klasifikace nemocí pro onkologii; JCA – Společné klinické hodnocení.
Zbývající prováděcí akty a pokyny
Prováděcí akt |
Konečný termín |
Stav |
|
Procesní pravidla pro JCA léčivých přípravků |
1.–2. čtvrtletí 2024 |
Přijato 23. května 2024 |
|
Pravidla pro spolupráci prostřednictvím výměny informací s agenturou EMA |
3. čtvrtletí 2024 |
Přijato 18. října 2024 |
|
Procesní pravidla pro řešení střetu zájmů |
3. čtvrtletí 2024 |
Přijato 25. října 2024 |
|
Procesní pravidla pro a.s. léčivých přípravků |
3. čtvrtletí 2024 |
Konečná verze se připravuje, veřejná konzultace uzavřena |
|
Procesní pravidla pro a.s. zdravotnických prostředků a diagnostických zdravotnických prostředků in vitro |
4. čtvrtletí 2024 |
Veřejná konzultace otevřena do 26. listopadu 2024 |
|
Procesní pravidla pro JCA zdravotnických prostředků a diagnostických zdravotnických prostředků in vitro |
4. čtvrtletí 2024 |
Plánovaný |
Klíč: EMA – Evropská agentura pro léčivé přípravky; IVD – diagnostika in vitro; JCA – Společné klinické hodnocení; JSC – Společná vědecká konzultace.
Kromě toho se v současné době připravuje více než 10 pokynů, které by měly být zveřejněny před tím, než JCA vstoupí v platnost. Zúčastněné strany mimo jiné obzvláště dychtivě očekávají pokyny popisující vědeckou metodiku procesu stanovení rozsahu, neboť se očekává, že doplní předchozí předběžné pokyny EUnetHTA 21 týkající se toho, jak bude tento "první krok" procesu JCA, jako je definice souboru údajů (soubor, intervence, komparátor, výsledek) pro oblast působnosti JCA.
Zahájení procesu JCA vývojářem zdravotnických technologií

Definice PICO
Tabulka 3. Porovnání simulací PICO v mCRPC pomocí EUnetHTA 21 a Cencora
|
|
EUnetHTA 21 |
Cencora |
|
Indikace |
Dospělí pacienti s progresivním metastazujícím kastračně rezistentním karcinomem prostaty (mCRPC) pozitivním na prostatický membránový antigen (PSMA), kteří byli léčeni inhibicí dráhy androgenních receptorů (AR) a chemoterapií založenou na taxanech |
|
|
Počet dotčených členských států |
8 (Země neuvedeny) |
16 (Belgie, Česká republika, Dánsko, Finsko, Francie, Německo, Řecko, Irsko, Itálie, Lucembursko, Nizozemsko, Norsko, Polsko, Portugalsko, Španělsko a Švédsko) |
|
Výsledky (č.) |
|
|
|
Populace |
Plná licencovaná populace + 4 subpopulace |
Plná licencovaná populace + 4 subpopulace |
|
Intervence |
Pluvicto |
Přípravek Cenpicomab |
|
Komparátory |
6 |
12 |
|
Výsledky |
21 |
20 (viz Obrázek 1) |
|
Konsolidované PICO |
6, z toho 2 pro celou licencovanou populaci |
18, z toho 9 pro celou populaci s licencí (viz tabulka 4) |
|
Datum průzkumu PICO |
Listopad 2022 |
Květen 2024 |
Vysvětlivky: ne. –číslo; PICO – populace, intervence, komparátor, výsledek.
Ze srovnání obou simulací vyplývá, že zahrnutí širšího spektra členských států a prodloužení lhůty pro zachycení naposledy schválených referenčních subjektů může vést k významnému nárůstu konsolidovaných PICO, které je třeba vzít v úvahu pro oblast působnosti JCA, a to v důsledku rozdílů v klinických pokynech, léčebných standardech a rychlosti přístupu nových léčivých přípravků na trh v zemích EU.
Komparátory
Podle praktického pokynu EUnetHTA 21 má každý požadovaný srovnávací subjekt v zahrnutých zemích za následek samostatný PICO pro rozsah posouzení. Na základě těchto praktických pokynů vedla analýza společnosti Cencora k vysokému počtu PICO pro celou populaci, což bylo způsobeno požadavkem pěti ze 16 zemí (Německa, Irska, Itálie, Portugalska a Španělska) zahrnout do klinického hodnocení všechny místně relevantní srovnávací subjekty, což zahrnovalo rozsah dvou srovnávacích subjektů v Itálii a sedmi srovnávacích subjektů v Portugalsku. Naproti tomu tři země (Česká republika, Francie a Nizozemsko) uvedly, že posouzení na základě jednoho místně relevantního srovnávacího subjektu je dostatečné, jiná země (Polsko) uvedla, že příslušná referenční osoba bude vybrána na základě nejvyššího podílu na trhu, a pět zemí (Belgie, Dánsko, Finsko, Norsko a Švédsko) zdůraznilo, že příslušná možnost léčby by závisela na umístění přípravku (tj. linie léčby) HTD. V Lucembursku je posouzení založeno na dokumentaci předložené v úředním "pays de provenance" (tj. země původu, obvykle Belgie). V Řecku byla pro rozsah posouzení považována za relevantní pouze jedna referenční osoba. Tabulka 4 ukazuje identifikované PICO pro celou populaci cenpicomabu.
Pro analýzu EUnetHTA 21 nebyly zveřejněny požadavky specifické pro jednotlivé země, což odráží proces stanovení rozsahu v rámci smíšeného schválení, kdy odpovědi jednotlivých zemí nebudou HTD k dispozici.
|
|
Referenční osoby, které jsou předmětem zájmu pro celou populaci pro přípravek cenpicomab |
Země požadující každý komparátor |
PICO 1 |
Abirateron + prednison/prednisolon |
BE, DE, FI, FR, IE, LU, NL, NO, PT, SE |
PICO 2 |
Nejlepší podpůrná péče* |
DE, DK, ES, FI, IE, NL, NO, SE |
PICO 3 |
Cabazitaxel + prednison/prednisolon* |
BE, DE,DK, ES, FI, IE, IT, LU, NL, NO, PT, SE |
PICO 4 |
Docetaxel + prednison/prednisolon* |
BE, DK, FI, IE, LU, NL, NO, PT, SE |
PICO 5 |
Enzalutamid |
BE, DE,DK, FI, FR, IE, LU, NL, NO, PT, SE |
PICO 6 |
Lutecium (177Lu) vipivotid tetraxetan + androgenní deprivační terapie* |
BE, DE,FI, GR, IE, IT,NL, PO, PT
|
PICO 7 |
Olaparib* |
DK, PT |
PICO 8 |
Radium-223* |
ES, FI, PO |
PICO 9 |
Radium-223 + analog hormonu uvolňujícího luteinizační hormon* |
PO, PT |
Klíč: BE – Belgie; CZ – Česká republika; DE – Německo; DK – Dánsko; ES – Španělsko; FI – Finsko; FR – Francie; GR – Řecko; IE – Irsko; IT – Itálie; LU – Lucembursko; NL – Nizozemsko; NE – Norsko; PICO – populace, intervence, komparátor, výsledek; PO – Polsko; PT – Portugalsko; SE – Švédsko.
Poznámka: Tučně vyznačené země představují země, ze kterých byl PICO odvozen na základě žádosti o údaje proti všem identifikovaným komparátorům.
*Komparátory jsou také uvažovány v PICO pro subpopulace (zde nejsou uvedeny).
Možnost rozsáhlých PICO vyplývajících z fáze scoping byla potvrzena v nedávné simulaci EFPIA pro tři registrované onkologické léčby, včetně léčivých přípravků pro vzácná onemocnění a ATMP, což vedlo k velkému počtu potenciálních PICO v sedmi zemích, v rozmezí od sedmi do 23 PICO po konsolidaci.
Výsledky
Obrázek 1. Počet zemí, které požadují údaje o konkrétních klinických výsledcích
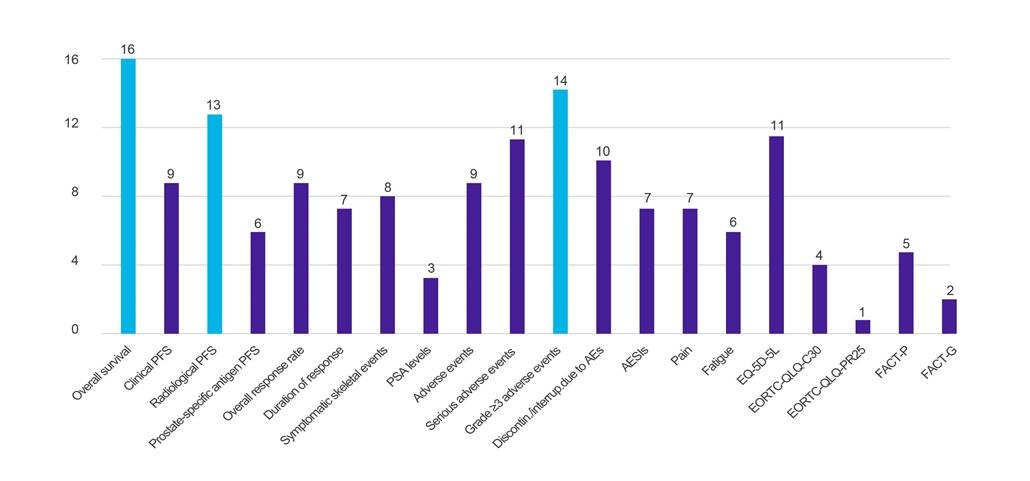
Klíč: AE – nežádoucí příhoda; AESI – nežádoucí událost zvláštního zájmu; EORTC-QLQ-C30 – Dotazník Evropské organizace pro výzkum a léčbu rakoviny o kvalitě života (-jádro, 30 položek); EORTC-QLQ-PR25 – Dotazník Evropské organizace pro výzkum a léčbu rakoviny o kvalitě života (-prostata, 25 položek); EQ-5D-5L – EuroQol-5 Dimension-5 Úroveň; FACT-G – Funkční hodnocení léčby rakoviny – obecně; FACT-P – Funkční hodnocení léčby rakoviny – prostaty; PFS – přežití bez progrese; PSA – prostatický specifický antigen.
Závěry

Vzhledem k tomu, že do vstupu JCA v platnost zbývají necelé dva měsíce a stále se čeká na metodické pokyny, přetrvávají značné nejistoty jak pro odvětví, tak pro orgány pro hodnocení zdravotnických technologií, pokud jde o proces stanovení rozsahu, který tvoří základ JCA. Cvičení PICO organizovaná HTACG a zahrnující různé orgány pro hodnocení zdravotnických technologií, jakož i simulace PICO prováděné HTD, mají zásadní význam pro přípravu klíčových zúčastněných stran na nadcházející JCA z hlediska schopností a vnitřní strategie. Teprve se však uvidí, jak se tyto simulace promítnou do skutečného společného komplexního akčního plánu a jaký dopad bude mít posouzení na přístup na místní trh. Hodnocení zdravotnických technologií EU bude během počátečních společných akcí fungovat jako vzdělávací systém a pro vytvoření účinného systému bude mít zásadní význam spolupráce, úsilí a zpětná vazba všech zúčastněných stran.
Zdroje
-
EUnetHTA 21. Praktický návod. D4.2 Proces stanovení rozsahu. Verze 1.0. 2022. Přístup 23. září 2024. https://www.eunethta.eu/wp-content/uploads/2022/09/EUnetHTA-21-D4.2-practical-guideline-on-scoping-process-v1.0.pdf
-
EUnetHTA 21. Konsolidovaná společnost PICO. Cvičení PICO I – Pluvicto. Verze 1.0. 2023. Přístup 23. září 2024. https://www.eunethta.eu/wp-content/uploads/2023/09/EUnetHTA-21-PICO-1-Deliverbale-1.pdf
-
Evropská komise. Nařízení Evropského parlamentu a Rady (ES) 2021/2282 ze dne 15. prosince 2021 o hodnocení zdravotnických technologií a o změně směrnice 2011/24/EU. 2021. Přístup 23. září 2024. https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32021R2282
-
Evropská komise. Od teorie k praxi: provádění nařízení EU o hodnocení zdravotnických technologií. 2023. Přístup 11. května 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-05-11_en
-
Evropská komise. Od teorie k praxi: provádění nařízení EU o hodnocení zdravotnických technologií. 2023. Přístup 18. září 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-09-18_en
-
Evropská komise. Od teorie k praxi: provádění nařízení EU o hodnocení zdravotnických technologií. 2023. Přístup 22. listopadu 2023. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2023-11-22_en
-
Evropská komise. Od teorie k praxi: provádění nařízení EU o hodnocení zdravotnických technologií. 2024. Přístup 30. ledna 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-01-30_en
-
Evropská komise. Od teorie k praxi: provádění nařízení EU o hodnocení zdravotnických technologií. 2024. Přístup 9. dubna 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-04-09_en
-
Evropská komise. Od teorie k praxi: provádění nařízení EU o hodnocení zdravotnických technologií. 2024. Přístup 23. září 2024. https://health.ec.europa.eu/events/theory-practice-implementing-eu-health-technology-assessment-regulation-2024-09-06_en
-
Evropská komise. Průběžný plán provádění na období 2023–2024. Aktualizováno v září 2024. Přístup 23. září 2024. https://health.ec.europa.eu/document/download/397b2a2e-1793-48fd-b9f5-7b8f0b05c7dd_en
-
Evropská komise. Hodnocení zdravotnických technologií – společná klinická hodnocení zdravotnických prostředků. 2024. Přístup 5. listopadu 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13707-Health-technology-assessment-joint-clinical-assessments-of-medical-devices_en
-
Evropská komise. Hodnocení zdravotnických technologií – společná klinická hodnocení léčivých přípravků. 2024. Přístup 24. září 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13708-Health-technology-assessment-joint-clinical-assessments-of-medicinal-products_en
-
Evropská komise. Hodnocení zdravotnických technologií – procesní pravidla pro posuzování a řízení střetů zájmů. 2024. Přístup 23. září 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13751-Health-technology-assessment-procedural-rules-for-assessing-and-managing-conflicts-of-interest_en
-
Evropská komise. Hodnocení zdravotnických technologií – spolupráce s Evropskou agenturou pro léčivé přípravky. 2024. Přístup 23. září 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/14164-Health-technology-assessment-cooperation-with-the-European-Medicines-Agency_en
-
Evropská komise. Hodnocení zdravotnických technologií – společné vědecké konzultace o zdravotnických prostředcích a diagnostických zdravotnických prostředcích in vitro. 2024. Přístup 5. listopadu 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13752-Health-technology-assessment-joint-scientific-consultations-on-medical-devices-in-vitro-diagnostic-medical-devices_en
-
Evropská komise. Hodnocení zdravotnických technologií – společné vědecké konzultace o humánních léčivých přípravcích. 2024. Přístup 22. října 2024. https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13759-Health-technology-assessment-Joint-scientific-consultations-on-medicinal-products-for-human-use_en
-
Evropská komise. Společné klinické hodnocení léčivých přípravků: předkládání včasných informací ze strany subjektů zabývajících se vývojem zdravotnických technologií. 2024. Přístup 23. září 2024. https://health.ec.europa.eu/document/download/77476507-9ddc-47e3-ae0d-11c05f89169c_en?filename=hta_%20mp-jca_htd_en.pdf
-
Evropská federace farmaceutického průmyslu a asociací. Nařízení EU o hodnocení zdravotnických technologií pro onkologické léčivé přípravky: Poznatky ze simulace dopadu navrhovaných metod EUnetHTA21. 2024. Přístup 23. září 2024. https://www.efpia.eu/media/qrjah2ij/efpia-evidera-research-on-eunethta21-methods.pdf
-
Evropská agentura pro léčivé přípravky. Léčivé přípravky pro moderní terapii: Přehled. 2024. Přístup 23. září 2024. https://www.ema.europa.eu/en/human-regulatory-overview/advanced-therapy-medicinal-products-overview
-
HTACG. Vědecké specifikace léčivých přípravků podléhajících společnému klinickému hodnocení. 2024. Přístup 23. září 2024. https://health.ec.europa.eu/document/download/48974c78-1c37-4cf9-9fc9-a630fee9baac_en?filename=hta_mp_jca_sc-specifications_en.pdf
-
O'Donnell R. Od obav z PICO ke strategii PICO: plánování úspěchu EU HTA. 2024. Přístup 23. září 2024. https://www.amerisourcebergen.com/insights/manufacturers/from-pico-anxiety-to-pico-strategy




