Articol
Dezvăluirea lacunii de dovezi: Medicamente orfane vs. medicamente non-orfane în evaluările tehnologiilor medicale germane
Medicamentele pentru boli rare sunt adesea considerate lipsite de dovezi, deoarece au un beneficiu suplimentar garantat prin lege. Dar este justificată această prejudecată? Acest articol vă poartă într-o explorare edificatoare a evaluării tehnologiilor medicale în Germania pentru a elucida realitatea din spatele acestor ipoteze persistente.

Bolile rare și tratamentele lor în HTA germană
Bolile rare, care, prin definiție, afectează doar 1 din 2.000 de persoane din Uniunea Europeană, nu au adesea opțiuni de tratament eficiente. Medicamentele orfane (OD) completează acest gol și, prin urmare, primesc stimulente speciale pentru dezvoltarea și comercializarea lor. Pentru accesul pe piață în Germania, OD primesc un tratament unic în evaluarea tehnologiilor medicale (HTA).
ETM germană pentru medicamente este reglementată de Legea privind reorganizarea pieței farmaceutice, AMNOG. AMNOG își propune să echilibreze rambursarea pentru producătorii farmaceutici și povara cheltuielilor pentru sistemul național de sănătate. Medicamentele sunt obligate să fie supuse unei evaluări a beneficiilor în comparație cu o terapie standard existentă (așa-numita terapie comparativă adecvată [ACT]). O evaluare a beneficiului este obligatorie la lansarea unui medicament nou autorizat cu o substanță activă nouă în Germania sau pentru indicațiile nou autorizate ale unui medicament deja evaluat. Pe baza dovezilor clinice, Comitetul federal mixt (G-BA) evaluează beneficiul medical adăugat folosind șase categorii ("major", "considerabil", "minor", "necuantificabil", "fără beneficiu adăugat" sau "mai mic").
Pentru OD, un beneficiu medical suplimentar este acordat prin lege, iar evaluarea măsurii se bazează pe dovezi esențiale, fără obligația de a compara cu un ACT. Cu toate acestea, dacă vânzările ajung la 30 de milioane de euro sau indicația pierde statutul de orfan, reevaluarea în cadrul procesului de evaluare standard devine obligatorie. Medicamentele non-orfane (non-OD), fiind obligate la evaluarea regulată a beneficiilor, pot fi, de asemenea, supuse unei reevaluări, fie obligatoriu în cazul deciziilor temporare (de exemplu, se solicită date suplimentare de către G-BA), fie la cererea producătorului farmaceutic.
Evaluarea beneficiilor stă la baza negocierii prețului pentru rambursare între producătorul farmaceutic și Asociația Națională a Fondurilor Obligatorii de Asigurări de Sănătate (GKV-SV). Numai medicamentele cu un beneficiu medical suplimentar pot obține un preț mai mare decât costurile pentru ACT în negocierea prețului. În primele șase luni de la lansare, producătorul este liber să definească prețul de lansare, în timp ce prețul negociat se aplică începând cu a șaptea lună. Prețul de rambursare pentru un medicament se poate modifica și mai mult în timp, atunci când reevaluările și noile indicații pentru medicamentul respectiv trec prin HTA și negocierile ulterioare privind prețul.
Acest articol explorează rezultatele unei analize aprofundate a HTA germane, centrându-se pe compararea criteriilor de dovadă și a prețurilor între OD și non-OD (atât pentru evaluarea inițială, cât și pentru reevaluare) și își propune să facă lumină dacă OD nu au dovezi în HTA în comparație cu non-OD.
O analiză cuprinzătoare a analizat evaluările beneficiilor pentru DO și non-OD din 2011 până în mai 2024 dintr-o bază de date cu date G-BA. Această analiză a inclus 959 de evaluări ale beneficiilor. Dintre acestea, 810 au fost evaluări inițiale ale medicamentelor nou autorizate sau indicații nou autorizate ale unui medicament, în timp ce 149 au fost reevaluări, unele produse fiind reevaluate de mai multe ori pentru o indicație respectivă. Analiza a 810 evaluări inițiale ale beneficiilor a arătat că 27% dintre evaluări au evaluat OD, în timp ce 73% au fost non-OD. În total, a fost efectuată o reevaluare pentru 15% din toate evaluările (7% DO și 8% non-OD).
Orice reevaluări au fost asociate cu evaluarea inițială a beneficiului, dacă este cazul, pentru a alinia evaluările aferente pentru același medicament. Datele au fost extrase pentru DO și non-OD, concentrându-se pe parametri precum dovezile evaluate (tipurile de studii, numărul de studii și dimensiunea studiilor), nivelul beneficiului adăugat acordat și prețul. Evaluările s-au concentrat pe cazuri cu evaluare inițială (60 DO și 64 non-OD), cât și reevaluare (54 DO și 70 non-OD), reflectând faptul că unele medicamente și-au pierdut statutul de DO din perspectiva prevalenței și au fost reevaluate în cadrul procedurii standard ca non-OD) pentru o anumită indicație, pentru a evalua dacă dovezile, nivelul beneficiului și prețul s-au schimbat între evaluarea inițială și reevaluare, și pentru a compara între DO și non-OD.
Pentru OD, un beneficiu medical suplimentar este acordat prin lege, iar evaluarea măsurii se bazează pe dovezi esențiale, fără obligația de a compara cu un ACT. Cu toate acestea, dacă vânzările ajung la 30 de milioane de euro sau indicația pierde statutul de orfan, reevaluarea în cadrul procesului de evaluare standard devine obligatorie. Medicamentele non-orfane (non-OD), fiind obligate la evaluarea regulată a beneficiilor, pot fi, de asemenea, supuse unei reevaluări, fie obligatoriu în cazul deciziilor temporare (de exemplu, se solicită date suplimentare de către G-BA), fie la cererea producătorului farmaceutic.
Evaluarea beneficiilor stă la baza negocierii prețului pentru rambursare între producătorul farmaceutic și Asociația Națională a Fondurilor Obligatorii de Asigurări de Sănătate (GKV-SV). Numai medicamentele cu un beneficiu medical suplimentar pot obține un preț mai mare decât costurile pentru ACT în negocierea prețului. În primele șase luni de la lansare, producătorul este liber să definească prețul de lansare, în timp ce prețul negociat se aplică începând cu a șaptea lună. Prețul de rambursare pentru un medicament se poate modifica și mai mult în timp, atunci când reevaluările și noile indicații pentru medicamentul respectiv trec prin HTA și negocierile ulterioare privind prețul.
Acest articol explorează rezultatele unei analize aprofundate a HTA germane, centrându-se pe compararea criteriilor de dovadă și a prețurilor între OD și non-OD (atât pentru evaluarea inițială, cât și pentru reevaluare) și își propune să facă lumină dacă OD nu au dovezi în HTA în comparație cu non-OD.
O analiză cuprinzătoare a analizat evaluările beneficiilor pentru DO și non-OD din 2011 până în mai 2024 dintr-o bază de date cu date G-BA. Această analiză a inclus 959 de evaluări ale beneficiilor. Dintre acestea, 810 au fost evaluări inițiale ale medicamentelor nou autorizate sau indicații nou autorizate ale unui medicament, în timp ce 149 au fost reevaluări, unele produse fiind reevaluate de mai multe ori pentru o indicație respectivă. Analiza a 810 evaluări inițiale ale beneficiilor a arătat că 27% dintre evaluări au evaluat OD, în timp ce 73% au fost non-OD. În total, a fost efectuată o reevaluare pentru 15% din toate evaluările (7% DO și 8% non-OD).
Orice reevaluări au fost asociate cu evaluarea inițială a beneficiului, dacă este cazul, pentru a alinia evaluările aferente pentru același medicament. Datele au fost extrase pentru DO și non-OD, concentrându-se pe parametri precum dovezile evaluate (tipurile de studii, numărul de studii și dimensiunea studiilor), nivelul beneficiului adăugat acordat și prețul. Evaluările s-au concentrat pe cazuri cu evaluare inițială (60 DO și 64 non-OD), cât și reevaluare (54 DO și 70 non-OD), reflectând faptul că unele medicamente și-au pierdut statutul de DO din perspectiva prevalenței și au fost reevaluate în cadrul procedurii standard ca non-OD) pentru o anumită indicație, pentru a evalua dacă dovezile, nivelul beneficiului și prețul s-au schimbat între evaluarea inițială și reevaluare, și pentru a compara între DO și non-OD.

Comparabilitatea dovezilor prezentate pentru DO și non-DO
Pentru OD, un beneficiu suplimentar este acordat automat prin lege. Prin urmare, ce dovezi clinice sunt prezentate pentru OD în evaluările beneficiilor și cum diferă de evaluările non-OD? Ca un prim pas în evaluările standard ale beneficiilor, G-BA evaluează calitatea studiilor depuse pe baza nivelului de dovezi pentru a oferi un nivel suficient de fiabil de cunoștințe. Pe baza acestei evaluări, studiul este fie acceptat, fie nu este luat în considerare în evaluare. În plus, studiile furnizate pentru o evaluare standard a beneficiului trebuie să includă o comparație a medicamentului cu ACT, definită de G-BA. În timp ce DO beneficiază de o executare mai puțin strictă a criteriilor de dovadă pentru evaluările inițiale, cele care depășesc limita de vânzări sunt reevaluate în conformitate cu procedura standard, chiar dacă își păstrează statutul de orfan din perspectiva prevalenței.
Evaluările au arătat că studiile controlate randomizate (RCT), standardul de aur al dovezilor, au fost tipul de studiu predominant atât pentru OD, cât și pentru non-OD (Figura 1). Pentru non-OD, mai multe RCT au fost acceptate de G-BA în reevaluare (51/70 cazuri, 73%) decât în evaluarea inițială (44/64 cazuri, 69%), în timp ce a fost invers pentru DO (45/60 evaluări inițiale, 75%; 35/54 reevaluări, 65%).
Inițial, studiile clinice prezentate de producător au fost acceptate de G-BA în toate evaluările OD; majoritatea studiilor (45/60 cazuri, 75%) au fost RCT, iar 25% (15/60 cazuri, 25%) au fost non-RCT (de exemplu, studii cu un singur braț, dimensiuni mici ale studiilor, utilizarea de rezultate surogat). Când OD-urile au fost reevaluate într-o evaluare standard a beneficiilor, depășind limita de vânzări, proporția de RCT-uri acceptate și non-RCT-uri a scăzut la 65% (35/54 reevaluări) și, respectiv, 13% (7/54 reevaluări). În 12 dintre reevaluările OD (22%), studiile respective nu au fost acceptate de G-BA, reflectând criteriile de dovezi mai stricte aplicate în cadrul procesului de evaluare standard. Neîndeplinirea ACT ar putea fi principalul motiv pentru această schimbare.
Spre deosebire de OD, foarte puține non-RCT au fost acceptate în evaluările beneficiilor non-OD (2/64 evaluări inițiale; 1/70 reevaluări). Astfel, non-RCT-urile par mai susceptibile de a fi acceptate pentru OD decât pentru non-OD. Mai mult, dovezile producătorului au fost acceptate în toate evaluările inițiale ale OD, în timp ce studiile prezentate au fost respinse în 18 evaluări și reevaluări ale non-OD. Acest lucru se datorează faptului că în evaluările OD studiile pivot sunt întotdeauna acceptate prin lege.
Figura 1. Distribuția tipului de studiu între DO și non-OD în evaluarea inițială (IA) și reevaluarea (RA)
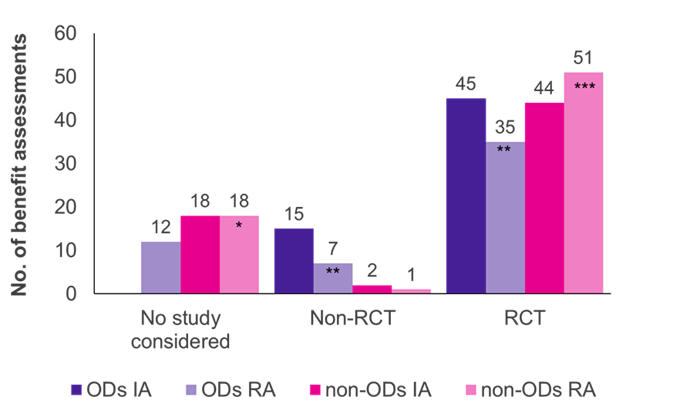
Cheie: IA – evaluarea inițială; Nu. –număr; OD – medicament orfan; RA – reevaluare; RCT – studiu controlat randomizat.
În plus, și nu este surprinzător, a existat o corelație pozitivă între o dimensiune crescută a populațiilor de studiu și disponibilitatea unui RCT (date neprezentate).
Inițial, studiile clinice prezentate de producător au fost acceptate de G-BA în toate evaluările OD; majoritatea studiilor (45/60 cazuri, 75%) au fost RCT, iar 25% (15/60 cazuri, 25%) au fost non-RCT (de exemplu, studii cu un singur braț, dimensiuni mici ale studiilor, utilizarea de rezultate surogat). Când OD-urile au fost reevaluate într-o evaluare standard a beneficiilor, depășind limita de vânzări, proporția de RCT-uri acceptate și non-RCT-uri a scăzut la 65% (35/54 reevaluări) și, respectiv, 13% (7/54 reevaluări). În 12 dintre reevaluările OD (22%), studiile respective nu au fost acceptate de G-BA, reflectând criteriile de dovezi mai stricte aplicate în cadrul procesului de evaluare standard. Neîndeplinirea ACT ar putea fi principalul motiv pentru această schimbare.
Spre deosebire de OD, foarte puține non-RCT au fost acceptate în evaluările beneficiilor non-OD (2/64 evaluări inițiale; 1/70 reevaluări). Astfel, non-RCT-urile par mai susceptibile de a fi acceptate pentru OD decât pentru non-OD. Mai mult, dovezile producătorului au fost acceptate în toate evaluările inițiale ale OD, în timp ce studiile prezentate au fost respinse în 18 evaluări și reevaluări ale non-OD. Acest lucru se datorează faptului că în evaluările OD studiile pivot sunt întotdeauna acceptate prin lege.
Figura 1. Distribuția tipului de studiu între DO și non-OD în evaluarea inițială (IA) și reevaluarea (RA)

Cheie: IA – evaluarea inițială; Nu. –număr; OD – medicament orfan; RA – reevaluare; RCT – studiu controlat randomizat.
Notă: Șase OD, evaluate inițial ca OD, au fost reevaluate ca non-OD din cauza pierderii statutului de OD (*s-au adăugat patru OD anterioare; **au fost reduse cu trei OD anterioare; ****au adăugat două OD anterioare).
În plus, și nu este surprinzător, a existat o corelație pozitivă între o dimensiune crescută a populațiilor de studiu și disponibilitatea unui RCT (date neprezentate).
Distribuția beneficiilor suplimentare acordate pentru DO și non-OD în evaluarea inițială
Gradul beneficiului suplimentar acordat este legat de dovezile furnizate. Este de remarcat faptul că acordarea "fără beneficiu suplimentar" nu este aplicabilă pentru DO în evaluarea beneficiului, iar gradul implicit al beneficiului medical suplimentar este "necuantificabil". Majoritatea evaluărilor inițiale ale OD au ca rezultat un beneficiu "necuantificabil" (Figura 2). Pentru non-OD, categoria de beneficii cea mai alocată a fost "fără beneficii suplimentare". Distribuția unui beneficiu suplimentar acordat în categoriile "considerabil" și "minor" a fost mai mult sau mai puțin comparabilă în evaluările inițiale DO și non-OD.
Figura 2. Beneficiu suplimentar acordat în evaluările inițiale

Figura 2. Beneficiu suplimentar acordat în evaluările inițiale

Cheie: Nu. –număr; OD – medicament orfan.
Evaluările beneficiilor au ca rezultat o scădere a prețurilor de rambursare (similar cu DO și non-OD)
O analiză a nivelurilor prețurilor înainte de evaluarea beneficiilor și după negocierea prețurilor a arătat o reducere a prețului de lansare prin procedura unei evaluări inițiale (OD: rabat de 18%; non-OD: rabat de 22%). O reevaluare a condus la o creștere suplimentară a rabatului, deși într-o măsură mai mică (rabat de 8% după reevaluare atât pentru OD, cât și pentru cei care nu sunt OD). Diferența de preț dintre OD și non-OD este mare. În medie, s-a constatat că DO sunt de aproximativ 10,2 până la 13,5 ori mai scumpe decât cele non-OD. Această diferență de cost a persistat la lansare, după evaluarea inițială a beneficiilor și între reevaluări (datele nu sunt prezentate).

Medicamente orfane: Echilibrarea costurilor ridicate cu dovezi solide
Analiza a arătat modul în care OD-urile, cu prețuri de obicei mai mari și dovezi mai puțin solide decât non-OD, sunt evaluate în sistemul de sănătate german. În timp ce OD reprezintă o mică parte din evaluările beneficiilor, cheltuielile lor considerabile, reflectate de prețurile ridicate de rambursare în comparație cu non-OD, subliniază impactul lor semnificativ asupra sistemului de sănătate. Costul ridicat al OD este influențat de mai mulți factori, în special de populația limitată de pacienți și de investițiile substanțiale în cercetare și dezvoltare. În special, costurile ridicate ale OD sunt discutate în mod repetat în ceea ce privește justificarea prețului lor în raport cu dovezile furnizate, în special atunci când se ia în considerare povara economică asupra sistemelor de sănătate.
Analizele au indicat comparabilitatea în dovezile prezentate, RCT-urile oferind baza de dovezi pentru majoritatea evaluărilor atât pentru OD, cât și pentru non-OD. După cum arată datele, statutul OD nu este neapărat asociat cu o lipsă de calitate a dovezilor, care a făcut obiectul dezbaterilor. Cu toate acestea, reducerea studiilor acceptate pentru DO în reevaluare subliniază dificultățile de abordare a ACT. După cum s-a anticipat, prevalența mică asociată cu bolile rare duce la provocări în efectuarea de RCT-uri extinse, evidențiind corelația dintre prevalența bolii și calitatea dovezilor. Cu toate acestea, s-a demonstrat că companiile farmaceutice prezintă dovezi de înaltă calitate, cu un număr semnificativ de RCT-uri efectuate pentru OD, în ciuda constrângerilor menționate mai sus.
În concluzie, medicamentele dezvoltate pentru boli rare prezintă provocări distincte pentru producători și autoritățile HTA. În timp ce "privilegiile de evaluare" îmbunătățesc disponibilitatea terapiilor pentru afecțiuni rare dificil de tratat, prudența este necesară atunci când sunt aplicate criterii de medicină bazate pe dovezi. Constatările noastre demonstrează că, în ciuda obstacolelor cu care se confruntă OD, sunt furnizate dovezi de înaltă calitate sub formă de RCT. Cu toate acestea, sistemul HTA recunoaște incompatibilitatea ocazională a RCT-urilor în domeniul bolilor rare, permițând în același timp o mai mare libertate în acceptarea non-RCT-urilor în evaluările OD.
Deși acest articol nu a aprofundat justificarea prețurilor ridicate ale OD, corelația lor de eficacitate sau raționamentul din spatele beneficiului suplimentar acordat, este necesară o evaluare suplimentară pentru a analiza aceste aspecte cheie și complexitatea lor în cadrul sistemului de sănătate german. Interacțiunea dintre costurile OD, puterea dovezilor pe care le oferă și valoarea pe care o aduc sistemelor de sănătate rămâne un subiect complex și în evoluție, care necesită o examinare și o analiză continuă.
În concluzie, medicamentele dezvoltate pentru boli rare prezintă provocări distincte pentru producători și autoritățile HTA. În timp ce "privilegiile de evaluare" îmbunătățesc disponibilitatea terapiilor pentru afecțiuni rare dificil de tratat, prudența este necesară atunci când sunt aplicate criterii de medicină bazate pe dovezi. Constatările noastre demonstrează că, în ciuda obstacolelor cu care se confruntă OD, sunt furnizate dovezi de înaltă calitate sub formă de RCT. Cu toate acestea, sistemul HTA recunoaște incompatibilitatea ocazională a RCT-urilor în domeniul bolilor rare, permițând în același timp o mai mare libertate în acceptarea non-RCT-urilor în evaluările OD.
Deși acest articol nu a aprofundat justificarea prețurilor ridicate ale OD, corelația lor de eficacitate sau raționamentul din spatele beneficiului suplimentar acordat, este necesară o evaluare suplimentară pentru a analiza aceste aspecte cheie și complexitatea lor în cadrul sistemului de sănătate german. Interacțiunea dintre costurile OD, puterea dovezilor pe care le oferă și valoarea pe care o aduc sistemelor de sănătate rămâne un subiect complex și în evoluție, care necesită o examinare și o analiză continuă.
Surse
-
Bundesministerium für Gesundheit (BMG). Seltene Erkrankungen. 2024. Accesat la 4 septembrie 2024. https://www.bundesgesundheitsministerium.de/themen/praevention/gesundheitsgefahren/seltene-erkrankungen.html
-
Bundesministerium der Justiz (BMJ). Sozialgesetzbuch (SGB) Fünftes Buch (V). Accesat la 4 septembrie 2024. https://www.gesetze-im-internet.de/sgb_5/__35a.html
-
Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen. Preis- und Kostenentwicklung von Orphan Drugs; Arbeitspapier [online]. 2024. Accesat la 19 septembrie 2024. https://dx.doi.org/10.60584/GA22-01




