Articolo
Svelare la lacuna delle prove: Farmaci orfani vs. farmaci non orfani nelle valutazioni delle tecnologie sanitarie tedesche
I farmaci per le malattie rare sono spesso pregiudicati privi di prove perché hanno un beneficio aggiuntivo garantito dalla legge. Ma questo pregiudizio è giustificato? Questo articolo ti porta in un'esplorazione illuminante della valutazione delle tecnologie sanitarie in Germania per chiarire la realtà dietro questi presupposti persistenti.

Le malattie rare e i loro trattamenti nell'HTA tedesco
Le malattie rare, che per definizione colpiscono solo 1 persona su 2.000 nell'Unione europea, spesso non dispongono di opzioni terapeutiche efficaci. I farmaci orfani (OD) colmano questa lacuna e ricevono quindi incentivi speciali per il loro sviluppo e la loro commercializzazione. Per l'accesso al mercato in Germania, gli OD ricevono un trattamento unico nella valutazione delle tecnologie sanitarie (HTA).
L'HTA tedesco per i medicinali è disciplinato dalla "Arzneimittelmarktneuordnungsgesetz" (Legge sulla riorganizzazione del mercato farmaceutico, AMNOG). AMNOG mira a bilanciare il rimborso per i produttori farmaceutici e l'onere di spesa per il sistema sanitario nazionale. I medicamenti sono obbligati a sottoporsi a una valutazione dei benefici rispetto a una terapia standard esistente (la cosiddetta terapia [ACT]comparativa appropriata). La valutazione del beneficio è obbligatoria quando si lancia sul mercato un medicamento di nuova omologazione con un nuovo principio attivo in Germania o per indicazioni di nuova omologazione di un farmaco già valutato. Sulla base delle evidenze cliniche, la Commissione paritetica federale (G-BA) valuta il beneficio medico aggiuntivo utilizzando sei categorie («maggiore», «considerevole», «minore», «non quantificabile», «nessun beneficio aggiunto» o «inferiore»).
Per gli OD, un beneficio medico aggiuntivo è concesso dalla legge e la valutazione della misura si basa su prove fondamentali senza l'obbligo di confrontare con un ACT. Tuttavia, se le vendite raggiungono i 30 milioni di euro o se l'indicazione perde lo status di orfana, la rivalutazione secondo il processo di valutazione standard diventa obbligatoria. Anche i farmaci non orfani (non-OD), essendo obbligati alla valutazione periodica delle prestazioni, possono essere sottoposti a una nuova valutazione, obbligatoriamente in caso di decisioni temporanee (ad esempio, dati aggiuntivi sono richiesti dal G-BA) o su richiesta del produttore farmaceutico.
La valutazione delle prestazioni è la base per la negoziazione dei prezzi per il rimborso tra il produttore farmaceutico e l'Associazione nazionale delle casse malati obbligatorie (GKV-SV). Solo i farmaci con un beneficio medico aggiuntivo possono ottenere un prezzo più alto rispetto ai costi per l'ACT nella negoziazione dei prezzi. Entro i primi sei mesi dal lancio, il produttore è libero di definire il prezzo di lancio, mentre il prezzo negoziato viene applicato a partire dal settimo mese. Il prezzo di rimborso di un farmaco può cambiare ulteriormente nel tempo, quando le rivalutazioni e le nuove indicazioni per il rispettivo farmaco passano attraverso l'HTA e le successive negoziazioni sui prezzi.
Questo articolo esplora i risultati di un'analisi approfondita delle HTA tedesche incentrata sul confronto dei criteri di evidenza e dei prezzi tra OD e non-OD (sia per la valutazione iniziale che per la rivalutazione) e mira a far luce se le OD mancano di evidenza nell'HTA rispetto alle non-OD.
Una revisione completa ha analizzato le valutazioni dei benefici per OD e non OD dal 2011 al maggio 2024 da un database di dati G-BA. Questa analisi ha incluso 959 valutazioni dei benefici. Di queste, 810 erano valutazioni iniziali di nuovi farmaci autorizzati o nuove indicazioni autorizzate di un farmaco, mentre 149 erano rivalutazioni, con alcuni prodotti rivalutati più di una volta per una rispettiva indicazione. L'analisi di 810 valutazioni iniziali dei benefici ha rivelato che il 27% delle valutazioni ha valutato OD, mentre il 73% erano non-OD. In totale, è stata eseguita una rivalutazione per il 15% di tutte le valutazioni (7% OD e 8% non-OD).
Eventuali rivalutazioni sono state abbinate alla rispettiva valutazione iniziale del beneficio, se applicabile, per allineare le valutazioni correlate per lo stesso farmaco. I dati sono stati estratti per OD e non OD concentrandosi su parametri quali le prove valutate (tipi di studio, numero di studi e dimensioni degli studi), il livello di beneficio aggiunto concesso e il prezzo. Le valutazioni si sono concentrate su casi con valutazione iniziale (60 OD e 64 non-OD) e rivalutazione (54 OD e 70 non-OD, riflettendo il fatto che alcuni farmaci hanno perso lo status di OD dal punto di vista della prevalenza e sono stati rivalutati secondo la procedura standard come non-OD) per una determinata indicazione per valutare se l'evidenza, il livello di beneficio e il prezzo sono cambiati tra la valutazione iniziale e la rivalutazione; e per confrontare tra OD e non-OD.
Per gli OD, un beneficio medico aggiuntivo è concesso dalla legge e la valutazione della misura si basa su prove fondamentali senza l'obbligo di confrontare con un ACT. Tuttavia, se le vendite raggiungono i 30 milioni di euro o se l'indicazione perde lo status di orfana, la rivalutazione secondo il processo di valutazione standard diventa obbligatoria. Anche i farmaci non orfani (non-OD), essendo obbligati alla valutazione periodica delle prestazioni, possono essere sottoposti a una nuova valutazione, obbligatoriamente in caso di decisioni temporanee (ad esempio, dati aggiuntivi sono richiesti dal G-BA) o su richiesta del produttore farmaceutico.
La valutazione delle prestazioni è la base per la negoziazione dei prezzi per il rimborso tra il produttore farmaceutico e l'Associazione nazionale delle casse malati obbligatorie (GKV-SV). Solo i farmaci con un beneficio medico aggiuntivo possono ottenere un prezzo più alto rispetto ai costi per l'ACT nella negoziazione dei prezzi. Entro i primi sei mesi dal lancio, il produttore è libero di definire il prezzo di lancio, mentre il prezzo negoziato viene applicato a partire dal settimo mese. Il prezzo di rimborso di un farmaco può cambiare ulteriormente nel tempo, quando le rivalutazioni e le nuove indicazioni per il rispettivo farmaco passano attraverso l'HTA e le successive negoziazioni sui prezzi.
Questo articolo esplora i risultati di un'analisi approfondita delle HTA tedesche incentrata sul confronto dei criteri di evidenza e dei prezzi tra OD e non-OD (sia per la valutazione iniziale che per la rivalutazione) e mira a far luce se le OD mancano di evidenza nell'HTA rispetto alle non-OD.
Una revisione completa ha analizzato le valutazioni dei benefici per OD e non OD dal 2011 al maggio 2024 da un database di dati G-BA. Questa analisi ha incluso 959 valutazioni dei benefici. Di queste, 810 erano valutazioni iniziali di nuovi farmaci autorizzati o nuove indicazioni autorizzate di un farmaco, mentre 149 erano rivalutazioni, con alcuni prodotti rivalutati più di una volta per una rispettiva indicazione. L'analisi di 810 valutazioni iniziali dei benefici ha rivelato che il 27% delle valutazioni ha valutato OD, mentre il 73% erano non-OD. In totale, è stata eseguita una rivalutazione per il 15% di tutte le valutazioni (7% OD e 8% non-OD).
Eventuali rivalutazioni sono state abbinate alla rispettiva valutazione iniziale del beneficio, se applicabile, per allineare le valutazioni correlate per lo stesso farmaco. I dati sono stati estratti per OD e non OD concentrandosi su parametri quali le prove valutate (tipi di studio, numero di studi e dimensioni degli studi), il livello di beneficio aggiunto concesso e il prezzo. Le valutazioni si sono concentrate su casi con valutazione iniziale (60 OD e 64 non-OD) e rivalutazione (54 OD e 70 non-OD, riflettendo il fatto che alcuni farmaci hanno perso lo status di OD dal punto di vista della prevalenza e sono stati rivalutati secondo la procedura standard come non-OD) per una determinata indicazione per valutare se l'evidenza, il livello di beneficio e il prezzo sono cambiati tra la valutazione iniziale e la rivalutazione; e per confrontare tra OD e non-OD.

Comparabilità delle evidenze presentate per OD e non-OD
Per i OD, un vantaggio aggiuntivo è automaticamente concesso dalla legge. Quindi, quali prove cliniche vengono presentate per le OD nelle valutazioni dei benefici e in che modo differiscono dalle valutazioni non OD? Come primo passo nella valutazione standard dei benefici, il G-BA valuta la qualità degli studi presentati in base al livello di evidenza per fornire un livello di conoscenza sufficientemente affidabile. Sulla base di questa valutazione, lo studio viene accettato o non preso in considerazione nella valutazione. Inoltre, gli studi forniti per una valutazione standard del beneficio devono includere un confronto del medicinale con l'ACT, definito dal G-BA. Mentre gli OD beneficiano di un'esecuzione meno rigorosa dei criteri di evidenza per le valutazioni iniziali, quelli che superano il limite di vendita vengono rivalutati secondo la procedura standard anche se mantengono lo status di orfani dal punto di vista della prevalenza.
Le valutazioni hanno mostrato che gli studi randomizzati controllati (RCT), il gold standard di evidenza, erano il tipo di studio predominante sia per le OD che per le non-OD (Figura 1). Per i non-OD, il G-BA ha accettato più RCT nella rivalutazione (51/70 casi, 73%) rispetto alla valutazione iniziale (44/64 casi, 69%), mentre è stato viceversa per gli OD (45/60 valutazioni iniziali, 75%; 35/54 rivalutazioni, 65%).
Inizialmente, gli studi clinici presentati dal produttore sono stati accettati dal G-BA in tutte le valutazioni OD; la maggior parte degli studi (45/60 casi, 75%) erano RCT e il 25% (15/60 casi, 25%) erano non-RCT (ad es. studi a braccio singolo, piccole dimensioni dello studio, uso di risultati surrogati). Quando gli OD sono stati rivalutati in una valutazione standard dei benefici, avendo superato il limite di vendita, la percentuale di RCT accettati e non RCT è scesa rispettivamente al 65% (35/54 rivalutazioni) e al 13% (7/54 rivalutazioni). In 12 delle rivalutazioni OD (22%), i rispettivi studi non sono stati accettati dal G-BA, riflettendo i criteri di evidenza più rigorosi applicati nell'ambito del processo di valutazione standard. Il mancato rispetto dell'ACT potrebbe essere la ragione principale di questo cambiamento.
A differenza delle OD, pochissime non-RCT sono state accettate nelle valutazioni dei benefici non-OD (2/64 valutazioni iniziali; 1/70 rivalutazioni). Pertanto, i non-RCT sembrano avere maggiori probabilità di essere accettati per le OD che per le non-OD. Inoltre, le prove del produttore sono state accettate in tutte le valutazioni iniziali di OD, mentre gli studi presentati sono stati respinti in 18 valutazioni e rivalutazioni di non-OD. Ciò è dovuto al fatto che nelle valutazioni OD gli studi registrativi sono sempre accettati dalla legge.
Figura 1. Distribuzione del tipo di studio tra OD e non OD nella valutazione iniziale (IA) e nella rivalutazione (RA)
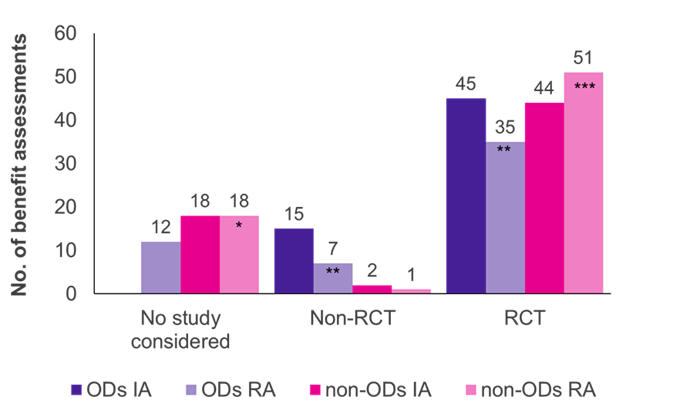
Chiave: IA – valutazione iniziale; No. –numero; OD – farmaco orfano; RA – rivalutazione; RCT – studio randomizzato controllato.
Inoltre, e non sorprendentemente, c'era una correlazione positiva tra una maggiore dimensione delle popolazioni in studio e la disponibilità di un RCT (dati non mostrati).
Inizialmente, gli studi clinici presentati dal produttore sono stati accettati dal G-BA in tutte le valutazioni OD; la maggior parte degli studi (45/60 casi, 75%) erano RCT e il 25% (15/60 casi, 25%) erano non-RCT (ad es. studi a braccio singolo, piccole dimensioni dello studio, uso di risultati surrogati). Quando gli OD sono stati rivalutati in una valutazione standard dei benefici, avendo superato il limite di vendita, la percentuale di RCT accettati e non RCT è scesa rispettivamente al 65% (35/54 rivalutazioni) e al 13% (7/54 rivalutazioni). In 12 delle rivalutazioni OD (22%), i rispettivi studi non sono stati accettati dal G-BA, riflettendo i criteri di evidenza più rigorosi applicati nell'ambito del processo di valutazione standard. Il mancato rispetto dell'ACT potrebbe essere la ragione principale di questo cambiamento.
A differenza delle OD, pochissime non-RCT sono state accettate nelle valutazioni dei benefici non-OD (2/64 valutazioni iniziali; 1/70 rivalutazioni). Pertanto, i non-RCT sembrano avere maggiori probabilità di essere accettati per le OD che per le non-OD. Inoltre, le prove del produttore sono state accettate in tutte le valutazioni iniziali di OD, mentre gli studi presentati sono stati respinti in 18 valutazioni e rivalutazioni di non-OD. Ciò è dovuto al fatto che nelle valutazioni OD gli studi registrativi sono sempre accettati dalla legge.
Figura 1. Distribuzione del tipo di studio tra OD e non OD nella valutazione iniziale (IA) e nella rivalutazione (RA)

Chiave: IA – valutazione iniziale; No. –numero; OD – farmaco orfano; RA – rivalutazione; RCT – studio randomizzato controllato.
Nota: Sei OD, inizialmente valutate come OD, sono state rivalutate come non-OD a causa della perdita dello status di OD (*aggiunte quattro OD precedenti; **ridotte di tre OD precedenti; ***aggiunte due OD precedenti).
Inoltre, e non sorprendentemente, c'era una correlazione positiva tra una maggiore dimensione delle popolazioni in studio e la disponibilità di un RCT (dati non mostrati).
Distribuzione dei benefici aggiunti concessi per OD e non OD nella valutazione iniziale
L'entità del beneficio aggiunto concesso è collegata alle prove fornite. Degno di nota è il fatto che la concessione di "nessun beneficio aggiunto" non è applicabile per gli OD nella valutazione del beneficio e il grado predefinito di beneficio medico aggiunto è "non quantificabile". La maggior parte delle valutazioni iniziali dell'OD si traduce in un beneficio "non quantificabile" (Figura 2). Per i non-OD, la categoria di prestazioni più assegnata è stata "nessuna prestazione aggiuntiva". La distribuzione di un beneficio aggiunto concesso nelle categorie «considerevole» e «minore» è risultata più o meno comparabile nelle valutazioni iniziali OD e non OD.
Figura 2. Concessione di un vantaggio aggiuntivo nelle valutazioni iniziali

Figura 2. Concessione di un vantaggio aggiuntivo nelle valutazioni iniziali

Chiave: No. –numero; OD – farmaco orfano.
Le valutazioni delle prestazioni si traducono in una diminuzione dei prezzi di rimborso (simile a OD e non OD)
Un'analisi dei livelli dei prezzi prima della valutazione dei benefici e dopo la negoziazione dei prezzi ha mostrato una riduzione del prezzo di lancio attraverso la procedura di una valutazione iniziale (OD: riduzione del 18%; non-OD: riduzione del 22%). Una nuova valutazione ha comportato un ulteriore aumento della riduzione, anche se in misura minore (riduzione dell'8% dopo la nuova valutazione sia per gli OD che per i non OD). La differenza di prezzo tra OD e non-OD è notevole. In media, gli OD sono risultati essere da 10,2 a 13,5 volte più costosi dei non-OD. Questa differenza di costo è persistita al momento del lancio, dopo la valutazione iniziale dei benefici e tra le rivalutazioni (dati non mostrati).

Farmaci orfani: Bilanciare i costi elevati con solide evidenze
L'analisi ha mostrato come gli OD, con prezzi tipicamente più elevati e prove meno solide rispetto ai non-OD, siano valutati nel sistema sanitario tedesco. Sebbene le OD costituiscano una piccola parte delle valutazioni delle prestazioni, le loro spese considerevoli, riflesse dagli elevati prezzi di rimborso rispetto alle non-OD, sottolineano il loro impatto significativo sul sistema sanitario. L'elevato costo delle OD è influenzato da molteplici fattori, in particolare dalla popolazione ristretta di pazienti e dai sostanziali investimenti in ricerca e sviluppo. In particolare, i costi elevati delle OD sono ripetutamente discussi in termini di giustificazione del loro prezzo in relazione alle prove fornite, soprattutto se si considera l'onere economico per i sistemi sanitari.
Le analisi hanno indicato la comparabilità delle evidenze presentate, con gli RCT che forniscono la base di prove per la maggior parte delle valutazioni sia per le OD che per le non-OD. Come dimostrano i dati, lo status di OD non è necessariamente associato a una mancanza di qualità delle prove, che è stata oggetto di dibattiti. Tuttavia, la riduzione degli studi accettati per le OD nella nuova valutazione sottolinea le difficoltà di affrontare l'ACT. Come anticipato, la piccola prevalenza associata alle malattie rare comporta difficoltà nella conduzione di RCT estesi, evidenziando la correlazione tra prevalenza della malattia e qualità delle evidenze. Tuttavia, è stato dimostrato che le aziende farmaceutiche presentano evidenze di alta qualità, con un numero significativo di RCT condotti per le OD, nonostante i vincoli sopra menzionati.
In conclusione, i farmaci sviluppati per le malattie rare presentano sfide distinte per i produttori e le autorità HTA. Mentre i "privilegi di valutazione" migliorano la disponibilità di terapie per malattie rare difficili da trattare, la cautela è giustificata quando si applicano criteri di medicina basati sull'evidenza. I nostri risultati dimostrano che, nonostante gli ostacoli affrontati dalle OD, vengono fornite prove di alta qualità sotto forma di RCT. Tuttavia, il sistema HTA riconosce l'occasionale non fattibilità degli RCT nel campo delle malattie rare, pur consentendo un maggiore margine di manovra nell'accettazione di non-RCT nelle valutazioni OD.
Sebbene questo articolo non abbia approfondito la giustificazione dei prezzi elevati degli OD, la loro correlazione di efficacia o la logica alla base del beneficio aggiunto concesso, è necessaria un'ulteriore valutazione per analizzare questi aspetti chiave e la loro complessità all'interno del sistema sanitario tedesco. L'interazione tra i costi delle OD, la forza delle evidenze che offrono e il valore che apportano ai sistemi sanitari rimane un argomento complesso e in evoluzione che richiede un esame e un'analisi continui.
In conclusione, i farmaci sviluppati per le malattie rare presentano sfide distinte per i produttori e le autorità HTA. Mentre i "privilegi di valutazione" migliorano la disponibilità di terapie per malattie rare difficili da trattare, la cautela è giustificata quando si applicano criteri di medicina basati sull'evidenza. I nostri risultati dimostrano che, nonostante gli ostacoli affrontati dalle OD, vengono fornite prove di alta qualità sotto forma di RCT. Tuttavia, il sistema HTA riconosce l'occasionale non fattibilità degli RCT nel campo delle malattie rare, pur consentendo un maggiore margine di manovra nell'accettazione di non-RCT nelle valutazioni OD.
Sebbene questo articolo non abbia approfondito la giustificazione dei prezzi elevati degli OD, la loro correlazione di efficacia o la logica alla base del beneficio aggiunto concesso, è necessaria un'ulteriore valutazione per analizzare questi aspetti chiave e la loro complessità all'interno del sistema sanitario tedesco. L'interazione tra i costi delle OD, la forza delle evidenze che offrono e il valore che apportano ai sistemi sanitari rimane un argomento complesso e in evoluzione che richiede un esame e un'analisi continui.
Fonti
-
Bundesministerium für Gesundheit (BMG). Seltene Erkrankungen. 2024. Accesso effettuato il 4 settembre 2024. https://www.bundesgesundheitsministerium.de/themen/praevention/gesundheitsgefahren/seltene-erkrankungen.html
-
Bundesministerium der Justiz (BMJ). Sozialgesetzbuch (SGB) Fünftes Buch (V). Accesso effettuato il 4 settembre 2024. https://www.gesetze-im-internet.de/sgb_5/__35a.html
-
Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen. Preis- und Kostenentwicklung von Orphan Drugs; Arbeitspapier [online]. 2024. Accesso effettuato il 19 settembre 2024. https://dx.doi.org/10.60584/GA22-01




