Artikel
De bewijskloof blootleggen: Weesgeneesmiddelen versus niet-weesgeneesmiddelen in Duitse beoordelingen van gezondheidstechnologie
Geneesmiddelen voor zeldzame ziekten worden vaak als onvoldoende bewijs beschouwd omdat ze wettelijk een gegarandeerd bijkomend voordeel hebben. Maar is dit vooroordeel gerechtvaardigd? Dit artikel neemt u mee op een verhelderende verkenning van de beoordeling van gezondheidstechnologie in Duitsland om de realiteit achter deze aanhoudende aannames te verduidelijken.

Zeldzame ziekten en hun behandelingen in de Duitse HTA
Zeldzame ziekten, die per definitie slechts 1 op de 2.000 mensen in de Europese Unie treffen, hebben vaak geen effectieve behandelingsopties. Weesgeneesmiddelen vullen deze leemte op en krijgen daarom speciale stimulansen voor de ontwikkeling en commercialisering ervan. Voor markttoegang in Duitsland krijgen OD's een unieke behandeling in de beoordeling van gezondheidstechnologie (HTA).
De Duitse EGT voor geneesmiddelen wordt geregeld door het "Arzneimittelmarktneuordnungsgesetz" (wet op de marktordening voor farmaceutische producten, AMNOG). AMNOG streeft naar een evenwicht tussen de vergoeding voor farmaceutische fabrikanten en de uitgavenlast voor het nationale gezondheidszorgstelsel. Geneesmiddelen zijn verplicht om een batenbeoordeling te ondergaan ten opzichte van een bestaande standaardtherapie (de zogenaamde passende vergelijkende therapie [ACT]). Een batenbeoordeling is verplicht bij het op de markt brengen van een nieuw toegelaten geneesmiddel met een nieuwe werkzame stof in Duitsland of voor nieuw toegelaten indicaties van een reeds beoordeeld geneesmiddel. Op basis van het klinische bewijs beoordeelt het Federaal Gemengd Comité (G-BA) het toegevoegde medische voordeel aan de hand van zes categorieën ('groot', 'aanzienlijk', 'klein', 'niet-kwantificeerbaar', 'geen extra voordeel' of 'minder').
Voor OD's wordt bij wet een extra medisch voordeel toegekend en is de beoordeling van de omvang gebaseerd op cruciaal bewijs zonder de verplichting om te vergelijken met een ACT. Als de verkoop echter 30 miljoen euro bedraagt of als de indicatie de status van weesgeneesmiddel verliest, wordt een herbeoordeling volgens het standaardevaluatieproces verplicht. Niet-weesgeneesmiddelen (niet-OD's), die verplicht zijn tot de reguliere beoordeling van de uitkeringen, kunnen ook worden onderworpen aan een herbeoordeling, hetzij verplicht in het geval van tijdelijke beslissingen (bijv. aanvullende gegevens worden opgevraagd door de G-BA), hetzij op verzoek van de farmaceutische fabrikant.
De beoordeling van de uitkeringen vormt de basis voor de prijsonderhandelingen voor vergoeding tussen de farmaceutische fabrikant en de Nationale Vereniging van Wettelijke Ziekenfondsen (GKV-SV). Alleen geneesmiddelen met een bijkomend medisch voordeel kunnen een hogere prijs krijgen dan de kosten voor de ACT in de prijsonderhandeling. Binnen de eerste zes maanden na de lancering is de fabrikant vrij om de lanceringsprijs te bepalen, terwijl de onderhandelde prijs vanaf de zevende maand wordt toegepast. De vergoedingsprijs voor een geneesmiddel kan in de loop van de tijd verder veranderen wanneer herbeoordelingen en nieuwe indicaties voor het betreffende geneesmiddel door HTA en daaropvolgende prijsonderhandelingen gaan.
Dit artikel onderzoekt de resultaten van een diepgaande analyse van Duitse HTA's, gericht op de vergelijking van bewijscriteria en prijsstelling tussen OD's en niet-OD's (voor zowel initiële beoordeling als herbeoordeling) en heeft tot doel licht te werpen op de vraag of OD's geen bewijs hebben in HTA in vergelijking met niet-OD's.
Een uitgebreide evaluatie analyseerde uitkeringsbeoordelingen voor OD's en niet-OD's van 2011 tot mei 2024 uit een database met G-BA-gegevens. Deze analyse omvatte 959 uitkeringsbeoordelingen. Hiervan waren 810 eerste beoordelingen van nieuw toegelaten geneesmiddelen of nieuw toegelaten indicaties van een geneesmiddel, terwijl 149 herbeoordelingen waren, waarbij sommige producten meer dan eens opnieuw werden beoordeeld voor een respectieve indicatie. Uit de analyse van 810 initiële uitkeringsbeoordelingen bleek dat 27% van de beoordelingen OD's evalueerde, terwijl 73% niet-OD's waren. In totaal werd voor 15% van alle beoordelingen (7% OD's en 8% niet-OD's) een herbeoordeling uitgevoerd.
Eventuele herbeoordelingen werden afgestemd op de respectieve initiële batenbeoordeling, indien van toepassing, om gerelateerde beoordelingen voor hetzelfde medicijn op elkaar af te stemmen. Er werden gegevens geëxtraheerd voor OD's en niet-OD's, waarbij de nadruk lag op parameters zoals beoordeeld bewijs (onderzoekstypes, aantal onderzoeken en omvang van onderzoeken), het niveau van het toegekende extra voordeel en de prijs. De evaluaties waren gericht op gevallen met zowel een initiële beoordeling (60 OD's en 64 niet-OD's) als een herbeoordeling (54 OD's en 70 niet-OD's, waaruit blijkt dat sommige geneesmiddelen de ODI-status verloren vanuit een prevalentieperspectief en opnieuw werden beoordeeld volgens de standaardprocedure als niet-OD's) voor een bepaalde indicatie om te beoordelen of het bewijs, de mate van voordeel en de prijs veranderden tussen de initiële beoordeling en de herbeoordeling; en om OD's en niet-OD's te vergelijken.
Voor OD's wordt bij wet een extra medisch voordeel toegekend en is de beoordeling van de omvang gebaseerd op cruciaal bewijs zonder de verplichting om te vergelijken met een ACT. Als de verkoop echter 30 miljoen euro bedraagt of als de indicatie de status van weesgeneesmiddel verliest, wordt een herbeoordeling volgens het standaardevaluatieproces verplicht. Niet-weesgeneesmiddelen (niet-OD's), die verplicht zijn tot de reguliere beoordeling van de uitkeringen, kunnen ook worden onderworpen aan een herbeoordeling, hetzij verplicht in het geval van tijdelijke beslissingen (bijv. aanvullende gegevens worden opgevraagd door de G-BA), hetzij op verzoek van de farmaceutische fabrikant.
De beoordeling van de uitkeringen vormt de basis voor de prijsonderhandelingen voor vergoeding tussen de farmaceutische fabrikant en de Nationale Vereniging van Wettelijke Ziekenfondsen (GKV-SV). Alleen geneesmiddelen met een bijkomend medisch voordeel kunnen een hogere prijs krijgen dan de kosten voor de ACT in de prijsonderhandeling. Binnen de eerste zes maanden na de lancering is de fabrikant vrij om de lanceringsprijs te bepalen, terwijl de onderhandelde prijs vanaf de zevende maand wordt toegepast. De vergoedingsprijs voor een geneesmiddel kan in de loop van de tijd verder veranderen wanneer herbeoordelingen en nieuwe indicaties voor het betreffende geneesmiddel door HTA en daaropvolgende prijsonderhandelingen gaan.
Dit artikel onderzoekt de resultaten van een diepgaande analyse van Duitse HTA's, gericht op de vergelijking van bewijscriteria en prijsstelling tussen OD's en niet-OD's (voor zowel initiële beoordeling als herbeoordeling) en heeft tot doel licht te werpen op de vraag of OD's geen bewijs hebben in HTA in vergelijking met niet-OD's.
Een uitgebreide evaluatie analyseerde uitkeringsbeoordelingen voor OD's en niet-OD's van 2011 tot mei 2024 uit een database met G-BA-gegevens. Deze analyse omvatte 959 uitkeringsbeoordelingen. Hiervan waren 810 eerste beoordelingen van nieuw toegelaten geneesmiddelen of nieuw toegelaten indicaties van een geneesmiddel, terwijl 149 herbeoordelingen waren, waarbij sommige producten meer dan eens opnieuw werden beoordeeld voor een respectieve indicatie. Uit de analyse van 810 initiële uitkeringsbeoordelingen bleek dat 27% van de beoordelingen OD's evalueerde, terwijl 73% niet-OD's waren. In totaal werd voor 15% van alle beoordelingen (7% OD's en 8% niet-OD's) een herbeoordeling uitgevoerd.
Eventuele herbeoordelingen werden afgestemd op de respectieve initiële batenbeoordeling, indien van toepassing, om gerelateerde beoordelingen voor hetzelfde medicijn op elkaar af te stemmen. Er werden gegevens geëxtraheerd voor OD's en niet-OD's, waarbij de nadruk lag op parameters zoals beoordeeld bewijs (onderzoekstypes, aantal onderzoeken en omvang van onderzoeken), het niveau van het toegekende extra voordeel en de prijs. De evaluaties waren gericht op gevallen met zowel een initiële beoordeling (60 OD's en 64 niet-OD's) als een herbeoordeling (54 OD's en 70 niet-OD's, waaruit blijkt dat sommige geneesmiddelen de ODI-status verloren vanuit een prevalentieperspectief en opnieuw werden beoordeeld volgens de standaardprocedure als niet-OD's) voor een bepaalde indicatie om te beoordelen of het bewijs, de mate van voordeel en de prijs veranderden tussen de initiële beoordeling en de herbeoordeling; en om OD's en niet-OD's te vergelijken.

Vergelijkbaarheid van het gepresenteerde bewijsmateriaal voor OD's en niet-OD's
Voor OD's wordt automatisch een extra voordeel toegekend door de wet. Dus, welk klinisch bewijs wordt gepresenteerd voor OD's in uitkeringsbeoordelingen, en hoe verschilt het van niet-OD-beoordelingen? Als eerste stap in standaard uitkeringsbeoordelingen beoordeelt de G-BA de kwaliteit van de ingediende studies op basis van het bewijsniveau om een voldoende betrouwbaar kennisniveau te bieden. Op basis van deze evaluatie wordt het onderzoek geaccepteerd of niet meegenomen in de beoordeling. Voorts moeten studies die worden verstrekt voor een standaardbeoordeling van de voordelen een vergelijking omvatten van het geneesmiddel met de ACT, gedefinieerd door de G-BA. Terwijl OD's profiteren van een minder strenge toepassing van bewijscriteria voor initiële beoordelingen, worden degenen die de verkooplimiet overschrijden opnieuw beoordeeld volgens de standaardprocedure, zelfs als ze de status van weesgeneesmiddel behouden vanuit een prevalentieperspectief.
De evaluaties toonden aan dat gerandomiseerde gecontroleerde onderzoeken (RCT's), de gouden standaard van bewijs, het overheersende onderzoekstype waren voor zowel OD's als niet-OD's (Figuur 1). Voor niet-OD's werden meer RCT's geaccepteerd door de G-BA bij herbeoordeling (51/70 zaken, 73%) dan bij initiële beoordeling (44/64 zaken, 69%), terwijl het omgekeerd was voor OD's (45/60 initiële beoordelingen, 75%; 35/54 herbeoordelingen, 65%).
Aanvankelijk werden de door de fabrikant ingediende klinische onderzoeken door de G-BA geaccepteerd in alle OD-beoordelingen; de meerderheid van de onderzoeken (45/60 gevallen, 75%) waren RCT's en 25% (15/60 gevallen, 25%) waren niet-RCT's (bijv. eenarmige onderzoeken, kleine onderzoeksomvang, gebruik van surrogaatuitkomsten). Wanneer OD's opnieuw werden beoordeeld in een standaard uitkeringsbeoordeling, nadat ze de verkooplimiet hadden overschreden, daalde het aandeel geaccepteerde RCT's en niet-RCT's tot respectievelijk 65% (35/54 herbeoordelingen) en 13% (7/54 herbeoordelingen). In 12 van de OD-herbeoordelingen (22%) werden de respectieve onderzoeken niet geaccepteerd door de G-BA, wat de strengere bewijscriteria weerspiegelt die worden toegepast in het standaardbeoordelingsproces. Het niet voldoen aan de ACT zou de belangrijkste reden voor deze verschuiving kunnen zijn.
In tegenstelling tot OD's werden zeer weinig niet-RCT's geaccepteerd in niet-OD-uitkeringsbeoordelingen (2/64 initiële beoordelingen; 1/70 herbeoordelingen). Niet-RCT's lijken dus eerder te worden geaccepteerd voor OD's dan voor niet-OD's. Verder werd het bewijs van de fabrikant geaccepteerd in alle initiële beoordelingen van OD, terwijl de gepresenteerde studies werden afgewezen in 18 beoordelingen en herbeoordelingen van niet-OD's. Dit komt door het feit dat bij OD-beoordelingen cruciale studies altijd wettelijk worden geaccepteerd.
Figuur 1. Verdeling van het onderzoekstype over OD's en niet-OD's in de initiële beoordeling (IA) en herbeoordeling (RA)
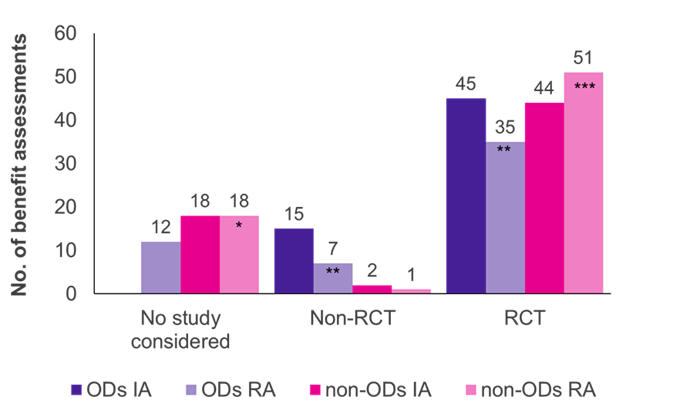
Sleutel: IA – eerste beoordeling; Nee. –getal; OD – weesgeneesmiddel; RA – herbeoordeling; RCT – gerandomiseerde gecontroleerde studie.
Bovendien, en niet verrassend, was er een positieve correlatie tussen een grotere omvang van onderzoekspopulaties en de beschikbaarheid van een RCT (gegevens niet getoond).
Aanvankelijk werden de door de fabrikant ingediende klinische onderzoeken door de G-BA geaccepteerd in alle OD-beoordelingen; de meerderheid van de onderzoeken (45/60 gevallen, 75%) waren RCT's en 25% (15/60 gevallen, 25%) waren niet-RCT's (bijv. eenarmige onderzoeken, kleine onderzoeksomvang, gebruik van surrogaatuitkomsten). Wanneer OD's opnieuw werden beoordeeld in een standaard uitkeringsbeoordeling, nadat ze de verkooplimiet hadden overschreden, daalde het aandeel geaccepteerde RCT's en niet-RCT's tot respectievelijk 65% (35/54 herbeoordelingen) en 13% (7/54 herbeoordelingen). In 12 van de OD-herbeoordelingen (22%) werden de respectieve onderzoeken niet geaccepteerd door de G-BA, wat de strengere bewijscriteria weerspiegelt die worden toegepast in het standaardbeoordelingsproces. Het niet voldoen aan de ACT zou de belangrijkste reden voor deze verschuiving kunnen zijn.
In tegenstelling tot OD's werden zeer weinig niet-RCT's geaccepteerd in niet-OD-uitkeringsbeoordelingen (2/64 initiële beoordelingen; 1/70 herbeoordelingen). Niet-RCT's lijken dus eerder te worden geaccepteerd voor OD's dan voor niet-OD's. Verder werd het bewijs van de fabrikant geaccepteerd in alle initiële beoordelingen van OD, terwijl de gepresenteerde studies werden afgewezen in 18 beoordelingen en herbeoordelingen van niet-OD's. Dit komt door het feit dat bij OD-beoordelingen cruciale studies altijd wettelijk worden geaccepteerd.
Figuur 1. Verdeling van het onderzoekstype over OD's en niet-OD's in de initiële beoordeling (IA) en herbeoordeling (RA)

Sleutel: IA – eerste beoordeling; Nee. –getal; OD – weesgeneesmiddel; RA – herbeoordeling; RCT – gerandomiseerde gecontroleerde studie.
Opmerking: Zes OD's, aanvankelijk beoordeeld als OD's, werden opnieuw beoordeeld als niet-OD's vanwege het verlies van de OD-status (*vier voormalige OD's toegevoegd; **verminderd met drie voormalige OD's; ***twee voormalige OD's toegevoegd).
Bovendien, en niet verrassend, was er een positieve correlatie tussen een grotere omvang van onderzoekspopulaties en de beschikbaarheid van een RCT (gegevens niet getoond).
Verdeling van toegekende extra voordelen voor OD's en niet-OD's in initiële beoordeling
De omvang van het toegekende extra voordeel is gekoppeld aan het verstrekte bewijsmateriaal. Opmerkelijk is dat het toekennen van 'geen extra voordeel' niet van toepassing is op OD's bij de beoordeling van de uitkeringen, en dat de standaardmate van extra medisch voordeel 'niet-kwantificeerbaar' is. De meeste initiële beoordelingen van OD resulteren in een 'niet-kwantificeerbaar' voordeel (figuur 2). Voor niet-OD's was de meest toegekende uitkeringscategorie 'geen extra voordeel'. De verdeling van een toegekend extra voordeel in de categorieën "aanzienlijk" en "gering" was min of meer vergelijkbaar in de eerste beoordelingen van OD en niet-OD.
Figuur 2. Toegekend extra voordeel bij eerste beoordelingen

Figuur 2. Toegekend extra voordeel bij eerste beoordelingen

Sleutel: Nee. –getal; OD – weesgeneesmiddel.
Uitkeringsbeoordelingen resulteren in een verlaging van de terugbetalingsprijzen (vergelijkbaar met OD's en niet-OD's)
Uit een analyse van de prijsniveaus vóór de beoordeling van de voordelen en na de prijsonderhandelingen bleek dat de aanvangsprijs werd verlaagd via de procedure van een eerste beoordeling (OD: 18% korting; niet-OD: 22% korting). Een herbeoordeling leidde tot een verdere verhoging van de korting, zij het in mindere mate (8% korting na herbeoordeling voor zowel OD's als niet-OD's). Het prijsverschil tussen OD's en niet-OD's is groot. Gemiddeld bleken OD's ongeveer 10,2 tot 13,5 keer duurder te zijn dan niet-OD's. Dit kostenverschil bleef bestaan bij de lancering, na de eerste beoordeling van de voordelen en bij herbeoordelingen (gegevens niet weergegeven).

Weesgeneesmiddelen: Hoge kosten in evenwicht brengen met sterk bewijs
De analyse liet zien hoe OD's, met doorgaans hogere prijzen en minder robuust bewijs dan niet-OD's, worden beoordeeld in het Duitse gezondheidszorgsysteem. Hoewel OD's een klein deel van de uitkeringsbeoordelingen uitmaken, onderstrepen hun aanzienlijke kosten, weerspiegeld door de hoge vergoedingsprijzen in vergelijking met niet-OD's, hun aanzienlijke impact op het gezondheidszorgstelsel. De hoge kosten van OD's worden beïnvloed door meerdere factoren, met name de beperkte patiëntenpopulatie en de aanzienlijke investeringen in onderzoek en ontwikkeling. Met name de hoge kosten van OD's worden herhaaldelijk besproken in termen van de vraag of hun prijs gerechtvaardigd is in verhouding tot het verstrekte bewijsmateriaal, met name wanneer rekening wordt gehouden met de economische last voor de gezondheidszorgstelsels.
De analyses wezen op vergelijkbaarheid in het gepresenteerde bewijsmateriaal, waarbij RCT's de wetenschappelijke basis vormden voor de meeste beoordelingen voor zowel OD's als niet-OD's. Zoals uit de gegevens blijkt, is de OD-status niet noodzakelijkerwijs geassocieerd met een gebrek aan kwaliteit van bewijsmateriaal, waarover is gedebatteerd. De vermindering van geaccepteerde studies voor OD's in de herbeoordeling benadrukt echter de moeilijkheden bij het aanpakken van de ACT. Zoals verwacht, leidt de kleine prevalentie geassocieerd met zeldzame ziekten tot uitdagingen bij het uitvoeren van uitgebreide RCT's, wat de correlatie tussen ziekteprevalentie en kwaliteit van het bewijs benadrukt. Er werd echter aangetoond dat farmaceutische bedrijven bewijsmateriaal van hoge kwaliteit indienen, met een aanzienlijk aantal RCT's voor OD's, ondanks de bovengenoemde beperkingen.
Concluderend stellen geneesmiddelen die zijn ontwikkeld voor zeldzame ziekten verschillende uitdagingen voor fabrikanten en HTA-autoriteiten. Hoewel 'beoordelingsprivileges' de beschikbaarheid van therapieën voor moeilijk te behandelen zeldzame aandoeningen verbeteren, is voorzichtigheid geboden wanneer evidence-based medicine-criteria worden toegepast. Onze bevindingen tonen aan dat ondanks de obstakels waarmee OD's worden geconfronteerd, bewijs van hoge kwaliteit in de vorm van RCT's wordt geleverd. Het EGT-systeem erkent echter dat RCT's af en toe onhaalbaar zijn op het gebied van zeldzame ziekten, terwijl er meer ruimte is om niet-RCT's te accepteren bij OD-beoordelingen.
Hoewel dit artikel niet inging op de rechtvaardiging van de hoge prijzen van OD's, hun correlatie met de werkzaamheid of de grondgedachte achter het toegekende extra voordeel, is verdere evaluatie gerechtvaardigd om deze belangrijke aspecten en hun complexiteit binnen het Duitse gezondheidszorgsysteem te analyseren. De wisselwerking tussen de kosten van OD's, de kracht van het bewijs dat ze bieden en de waarde die ze toevoegen aan gezondheidszorgstelsels blijft een complex en evoluerend onderwerp dat voortdurend onderzoek en analyse vereist.
Concluderend stellen geneesmiddelen die zijn ontwikkeld voor zeldzame ziekten verschillende uitdagingen voor fabrikanten en HTA-autoriteiten. Hoewel 'beoordelingsprivileges' de beschikbaarheid van therapieën voor moeilijk te behandelen zeldzame aandoeningen verbeteren, is voorzichtigheid geboden wanneer evidence-based medicine-criteria worden toegepast. Onze bevindingen tonen aan dat ondanks de obstakels waarmee OD's worden geconfronteerd, bewijs van hoge kwaliteit in de vorm van RCT's wordt geleverd. Het EGT-systeem erkent echter dat RCT's af en toe onhaalbaar zijn op het gebied van zeldzame ziekten, terwijl er meer ruimte is om niet-RCT's te accepteren bij OD-beoordelingen.
Hoewel dit artikel niet inging op de rechtvaardiging van de hoge prijzen van OD's, hun correlatie met de werkzaamheid of de grondgedachte achter het toegekende extra voordeel, is verdere evaluatie gerechtvaardigd om deze belangrijke aspecten en hun complexiteit binnen het Duitse gezondheidszorgsysteem te analyseren. De wisselwerking tussen de kosten van OD's, de kracht van het bewijs dat ze bieden en de waarde die ze toevoegen aan gezondheidszorgstelsels blijft een complex en evoluerend onderwerp dat voortdurend onderzoek en analyse vereist.
Bronnen
-
Bundesministerium für Gesundheit (BMG). Seltene Erkrankungen. 2024. Geraadpleegd op 4 september 2024. https://www.bundesgesundheitsministerium.de/themen/praevention/gesundheitsgefahren/seltene-erkrankungen.html
-
Bundesministerium der Justiz (BMJ). Sozialgesetzbuch (SGB) Fünftes Buch (V). Geraadpleegd op 4 september 2024. https://www.gesetze-im-internet.de/sgb_5/__35a.html
-
Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen. Preis- und Kostenentwicklung von Orphan Drugs; Arbeitspapier [online]. 2024. Geraadpleegd op 19 september 2024. https://dx.doi.org/10.60584/GA22-01




