¿Nuevas oportunidades para los medicamentos en Europa? Cómo la JCA y el Proyecto Orbis pueden afectar el potencial de ingresos de los medicamentos innovadores
JCA y el Proyecto Orbis: Acelerar el acceso de los pacientes a los tratamientos oncológicos en toda Europa


Si bien una amplia investigación ha explorado su impacto en factores clave de la industria, como el tiempo de comercialización (TTM) y la disponibilidad de medicamentos, sus implicaciones financieras, en particular su impacto en los ingresos de los medicamentos, han recibido comparativamente menos atención. Comprender estos efectos comerciales es crucial, ya que las aprobaciones aceleradas y un acceso más amplio pueden desbloquear nuevas oportunidades de ingresos y, al mismo tiempo, introducir desafíos de precios debido a las prácticas internacionales de precios de referencia (IRP) comúnmente aplicadas en toda Europa.

Resumen de JCA y el Proyecto Orbis
La JCA está diseñada para evaluar la eficacia y la seguridad de los nuevos productos a través de un enfoque colaborativo y armonizado entre los estados miembros de la Unión Europea (UE). Desde enero de 2025, la JCA es obligatoria para todos los medicamentos oncológicos y de terapia avanzada (ATMP). Los productos huérfanos de la Agencia Europea de Medicamentos (EMA) se incluirán en 2028, seguidos de todos los productos registrados en la EMA en 2030. Esta iniciativa afecta directamente a todos los Estados miembros de la UE27, Noruega e Islandia.
Proyecto Orbis
El Proyecto Orbis facilita la presentación y revisión simultánea de productos oncológicos entre socios reguladores internacionales. Dirigido por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA, por sus siglas en inglés), su objetivo principal es acelerar el acceso de los pacientes a tratamientos innovadores contra el cáncer que ofrezcan ventajas clínicas sobre las terapias existentes. Entre las autoridades reguladoras europeas participantes se encuentran la Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA) del Reino Unido (UK) y Suiza (Swissmedic).

Cuantificar el impacto en los ingresos
Nuestro enfoque comparó las proyecciones de ingresos en un escenario anterior a la JCA y el Proyecto Orbis, que representan las vías regulatorias y de reembolso tradicionales, con 5 escenarios de lanzamiento alternativos. Cada escenario incorporó diferentes supuestos sobre cómo JCA y el Proyecto Orbis influyen en TTM en cada país y en la generación de ingresos.
Escenario Pre-JCA y Proyecto Orbis
El potencial de ingresos antes de la introducción de JCA y el Proyecto Orbis se estimó en base a 48 productos oncológicos aprobados en Europa entre 2019 y 2022 que no participaron en el Proyecto Orbis. El TTM se definió como el número de días transcurridos entre la autorización de comercialización y la disponibilidad del paciente en cada país. Las proyecciones de ingresos durante un período de 5 años consideraron los precios de lista, el tamaño del mercado y las reglas del IRP:
- TTM se basó en el informe WAIT de la EFPIA
- Los precios de lista para cada país se determinaron en función de la mediana del costo anual del tratamiento de los productos oncológicos. Debido a la complejidad de la dinámica de los precios y al impacto de los descuentos poco transparentes, este análisis se basa en los precios de lista en lugar de los precios netos para garantizar la coherencia en la evaluación.
- Estimaciones del tamaño del mercado europeo, considerando la población y el gasto oncológico per cápita.
- Aplicaciones IRP en el lanzamiento y después del lanzamiento, siguiendo los datos de la matriz IRP de Navlin.
Escenario de JCA y Proyecto Orbis
Para evaluar el impacto de las diferentes tasas de aceleración, realizamos un análisis de sensibilidad, evaluando las implicaciones de ingresos para la aceleración TTM que oscila entre el 10% y el 40%.
En el marco del Proyecto Orbis, estimamos que Suiza podría experimentar aceleraciones de TTM de hasta 7 meses, una suposición basada en la brecha de presentación y los tiempos de revisión de los productos oncológicos en el marco del Proyecto Orbis frente a las vías que no pertenecen al Proyecto Orbis en Suiza. Sin embargo, no anticipamos ningún cambio para el Reino Unido, ya que no está claro si el cronograma regulatorio del Reino Unido se acelera realmente con el Proyecto Orbis. (ver Tabla 1).
Tabla 1. Resumen del escenario TTM
Escenario |
TTM (en inglés) |
|
Pre-JCA y Proyecto Orbis |
Mediana del TTM de los 48 productos oncológicos lanzados en Europa entre 2019 y 2022 |
|
Escenario 1 |
Reino Unido: No hay cambios en TTM CH: TTM acelerado de 7 meses BE, NE, DK, ES: 10% TTM acelerado + 100 días Otros países: TTM 10% acelerado |
|
Escenario 2 |
Reino Unido: No hay cambios en TTM CH: TTM acelerado de 7 meses BE, NE, DK, ES: 20% TTM acelerado + 100 días Otros países: 20% de TTM acelerado |
|
Escenario 3 (Escenario base) |
Reino Unido: No hay cambios en TTM CH: TTM acelerado de 7 meses BE, NE, DK, ES: Escenario TTM acelerado del 25 % + 100 días Otros países: 25% de TTM acelerado |
|
Escenario 4 |
Reino Unido: No hay cambios en TTM CH: TTM acelerado de 7 meses BE, NE, DK, ES: 30% TTM acelerado + 100 días Otros países: TTM un 30% acelerado |
|
Escenario 5 |
Reino Unido: No hay cambios en TTM CH: TTM acelerado de 7 meses BE, NE, DK, ES: 40% TTM acelerado + 100 días Otros países: TTM 40% acelerado |
Llave: SER: Bélgica; CH: Suiza; DK: Dinamarca; ES: España; JCA: Evaluación Clínica Conjunta; NE: Países Bajos; TTM: time to market; Reino Unido: Reino Unido.
Cálculos de ingresos
Usando nuestra calculadora de impuestos internos, realizamos una proyección integral de ingresos a 5 años para cada escenario y comparamos los resultados con el escenario anterior a la JCA y el Proyecto Orbis.
Nuestro análisis indica que, si bien los lanzamientos acelerados de productos conducen a una erosión de precios modesta pero notable (gráfico 1), las ventajas superan a los inconvenientes. Una entrada más rápida en el mercado permite captar una mayor cuota de mercado en un plazo más corto, lo que en última instancia aumenta la rentabilidad global (gráfico 2).
Además, nuestro análisis de sensibilidad a los ingresos en estos escenarios reveló un aumento potencial de los ingresos del 14 %, lo que subraya los posibles beneficios financieros de una estrategia de lanzamiento acelerada.

Llave: IRP: precios de referencia internacional; JCA: Evaluación Clínica Conjunta.
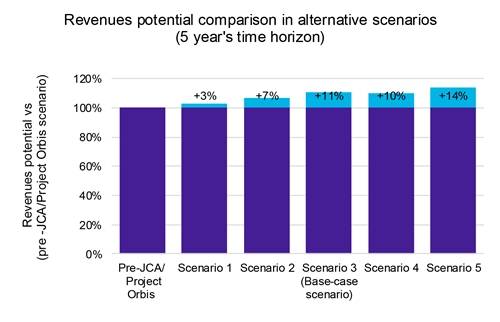
Llave: JCA: Evaluación Clínica Conjunta.
Conclusiones
Si bien la erosión más rápida de los precios sigue siendo una consideración, el aumento del volumen de ventas compensa este riesgo durante un período de 5 años. Como resultado, los fabricantes que adopten estrategias de lanzamiento acelerado en el marco de la JCA y el Proyecto Orbis pueden obtener ventajas financieras al tiempo que garantizan un acceso más amplio a terapias que salvan vidas.
Limitaciones de nuestros análisis
El análisis tiene varias limitaciones importantes:
- Cálculo de ingresos: Los ingresos se estiman utilizando precios de lista en lugar de precios netos, ya que los precios netos de los productos farmacéuticos están muy influenciados por acuerdos confidenciales y descuentos no revelados. Para garantizar la coherencia, los ingresos potenciales se evalúan en función de los precios de lista disponibles públicamente.
- TTM de referencia: El TTM estimado para el Reino Unido y Suiza antes de la JCA y el Proyecto Orbis puede diferir ligeramente de los supuestos de este análisis. Esta variación se debe a que nueve de los 48 productos utilizados para evaluar la TTM específica de cada país se evaluaron a través del Proyecto Orbis.
- Consideraciones sobre el IRP: Se han tenido en cuenta tanto las reglas formales como las informales del IRP. Sin embargo, las reglas informales del IRP son difíciles de evaluar debido a su implementación inconsistente. Se formularon hipótesis para estimar el grado en que se aplican estas políticas informales de fijación de precios.
Este artículo resume la comprensión de Cencora sobre el tema basándose en la información disponible públicamente en el momento de escribir este artículo (véanse las fuentes enumeradas) y la experiencia de los autores en esta área. Es posible que las recomendaciones proporcionadas en el artículo no sean aplicables a todas las situaciones y no constituyan asesoramiento legal; Los lectores no deben confiar en el artículo para tomar decisiones relacionadas con los temas tratados.
Conecte con nuestro equipo

Fuentes
- Federación Europea de Productos Farmacéuticos (EFPI). Encuesta de Pacientes W.A.I.T. Indicador 2023. Junio de 2024. https://efpia.eu/media/vtapbere/efpia-patient-wait-indicator-2024.pdf
- Unión Europea. Evaluación clínica conjunta de medicamentos. Enero de 2025. https://health.ec.europa.eu/document/download/ced91156-ffe1-472d-85eb-aa6a91dd707e_en?filename=hta_htar_factsheet-jca_en.pdf
- Gobierno del Reino Unido. Orientación sobre el Proyecto Orbis. Última actualización: 10 de enero de 2025. https://www.gov.uk/guidance/guidance-on-project-orbis
- Agencia Europea de Medicamentos. Autoridades nacionales competentes (humanas). https://www.ema.europa.eu/en/partners-networks/eu-partners/eu-member-states/national-competent-authorities-human
- Banco Mundial. Población total. Última actualización: 16 de diciembre de 2024. https://data.worldbank.org/indicator/SP.POP.TOTL
- Costo del tratamiento. 31 de diciembre de 2024. Obtenido de la base de datos Navlin.
- Normas internacionales de precios de referencia. 31 de diciembre de 2024. Obtenido de la base de datos Navlin.
- Vrdoljak E, Bodoky G, Jassem J, et al. Gastos en medicamentos oncológicos y relación entre la mortalidad y la incidencia del cáncer en Europa Central y Oriental. Oncólogo. 2019; 24(1):E30-E37. doi:10.1634/theoncologist.2018-0093. https://pmc.ncbi.nlm.nih.gov/articles/PMC6324644/
- Médico suizo. Proyecto Orbis: acceso más rápido a tratamientos prometedores contra el cáncer. 29 de mayo de 2024. https://www.swissmedic.ch/swissmedic/en/home/news/mitteilungen/project-orbis-schnellerer-zugang-krebsbehandlungen.html
- Asesores de precisión. El panorama del acceso al Reino Unido después del Brexit: ¿el Proyecto Orbis acelera significativamente el acceso de los pacientes a los medicamentos oncológicos en el Reino Unido en comparación con Europa? 2023. https://www.ispor.org/docs/default-source/intl2023/ispor23kennedyposter-project-orbis-pdf.pdf?sfvrsn=edc15b3_0



