Nieuwe kansen voor geneesmiddelen in Europa? Hoe JCA en Project Orbis het inkomstenpotentieel van innovatieve geneesmiddelen kunnen beïnvloeden
JCA en Project Orbis: Snellere toegang van patiënten tot oncologische behandelingen in heel Europa


Hoewel uitgebreid onderzoek hun impact op belangrijke factoren in de sector heeft onderzocht, zoals time-to-market (TTM) en beschikbaarheid van medicijnen, hebben hun financiële implicaties, met name hun impact op de inkomsten uit medicijnen, relatief minder aandacht gekregen. Inzicht in deze commerciële effecten is cruciaal, aangezien versnelde goedkeuringen en bredere toegang nieuwe inkomstenkansen kunnen ontsluiten en tegelijkertijd prijsuitdagingen kunnen introduceren als gevolg van internationale referentieprijzen (IRP) die vaak in heel Europa worden toegepast.

Overzicht van JCA en Project Orbis
JCA is ontworpen om de werkzaamheid en veiligheid van nieuwe producten te evalueren door middel van een gezamenlijke, geharmoniseerde aanpak in alle lidstaten van de Europese Unie (EU). Sinds januari 2025 is JCA verplicht voor alle oncologische en geavanceerde therapiegeneesmiddelen (ATMP's). Tegen 2028 zullen weesgeneesmiddelen van het Europees Geneesmiddelenbureau (EMA) worden opgenomen, gevolgd door alle EMA-geregistreerde producten tegen 2030. Dit initiatief heeft directe gevolgen voor alle EU27-lidstaten, Noorwegen en IJsland.
Project Orbis
Project Orbis faciliteert de gelijktijdige indiening en beoordeling van oncologieproducten door internationale regelgevende partners. Onder leiding van de Amerikaanse Food and Drug Administration (FDA) is het primaire doel om patiënten sneller toegang te geven tot innovatieve kankerbehandelingen die klinische voordelen bieden ten opzichte van bestaande therapieën. Deelnemende Europese regelgevende instanties zijn onder meer het Verenigd Koninkrijk (VK) Medicines and Healthcare products Regulatory Agency (MHRA) en Zwitserland (Swissmedic).

Kwantificering van de impact op de omzet
Onze aanpak vergeleek omzetprognoses onder een pre-JCA- en Project Orbis-scenario - dat traditionele regelgevings- en terugbetalingstrajecten vertegenwoordigt - met 5 alternatieve lanceringsscenario's. Elk scenario bevatte verschillende aannames over hoe JCA en Project Orbis TTM in elk land en het genereren van inkomsten beïnvloeden.
Pre-JCA en Project Orbis-scenario
Het inkomstenpotentieel vóór de introductie van JCA en Project Orbis werd geschat op basis van 48 oncologieproducten die tussen 2019 en 2022 in Europa zijn goedgekeurd en die niet hebben deelgenomen aan Project Orbis. TTM werd gedefinieerd als het aantal dagen tussen de vergunning voor het in de handel brengen en de beschikbaarheid van patiënten in elk land. Omzetprognoses over een periode van 5 jaar hielden rekening met de catalogusprijzen, marktomvang en IRP-regels:
- TTM was gebaseerd op het EFPIA WAIT-rapport
- De catalogusprijzen voor elk land werden bepaald op basis van de mediane jaarlijkse behandelingskosten van de oncologieproducten. Vanwege de complexiteit van de prijsdynamiek en de impact van niet-transparante kortingen, is deze analyse gebaseerd op catalogusprijzen in plaats van nettoprijzen om consistentie in de evaluatie te garanderen.
- Schattingen van de Europese marktomvang, rekening houdend met de bevolking en de oncologie-uitgaven per hoofd van de bevolking.
- IRP-applicaties bij lancering en na lancering, volgens gegevens uit de Navlin IRP-matrix.
JCA en Project Orbis-scenario
Om de impact van verschillende versnellingssnelheden te evalueren, hebben we een gevoeligheidsanalyse uitgevoerd, waarbij we de omzetimplicaties voor TTM-versnelling hebben beoordeeld, variërend van 10% tot 40%.
In het kader van Project Orbis schatten we dat Zwitserland TTM-versnellingen tot 7 maanden zou kunnen ervaren - een veronderstelling op basis van de indieningskloof en beoordelingstijden voor oncologieproducten in het kader van Project Orbis versus niet-Project Orbis-trajecten in Zwitserland. We verwachten echter geen veranderingen voor het VK, aangezien het onduidelijk is of de tijdlijn van de Britse regelgeving echt wordt versneld met Project Orbis. (zie Tabel 1).
Tabel 1. Samenvatting van het TTM-scenario
Scenario |
TTM |
|
Pre-JCA en Project Orbis |
Mediaan van de TTM van de 48 oncologieproducten die tussen 2019 en 2022 in Europa zijn gelanceerd |
|
Scenario 1 |
Verenigd Koninkrijk: Geen verandering in TTM CH: 7 maanden versnelde TTM BE, NE, DK, ES: 10% versnelde TTM + 100 dagen Andere landen: 10% versnelde TTM |
|
Scenario 2 |
Verenigd Koninkrijk: Geen verandering in TTM CH: 7 maanden versnelde TTM BE, NE, DK, ES: 20% versnelde TTM + 100 dagen Andere landen: 20% versnelde TTM |
|
Scenario 3 (Basisscenario) |
Verenigd Koninkrijk: Geen verandering in TTM CH: 7 maanden versnelde TTM BE, NE, DK, ES: 25% versneld TTM-scenario + 100 dagen Andere landen: 25% versnelde TTM |
|
Scenario 4 |
Verenigd Koninkrijk: Geen verandering in TTM CH: 7 maanden versnelde TTM BE, NE, DK, ES: 30% versnelde TTM + 100 dagen Andere landen: 30% versnelde TTM |
|
Scenario 5 |
Verenigd Koninkrijk: Geen verandering in TTM CH: 7 maanden versnelde TTM BE, NE, DK, ES: 40% versnelde TTM + 100 dagen Andere landen: 40% versnelde TTM |
Sleutel: ZIJN: België; CH: Zwitserland; DK: Denemarken; ES: Spanje; JCA: gezamenlijke klinische evaluatie; NE: Nederland; TTM: time-to-market; Verenigd Koninkrijk: Verenigd Koninkrijk.
Omzetberekeningen
Met behulp van onze interne omzetcalculator hebben we voor elk scenario een uitgebreide omzetprognose voor 5 jaar uitgevoerd en de resultaten vergeleken met het scenario pre-JCA en Project Orbis.
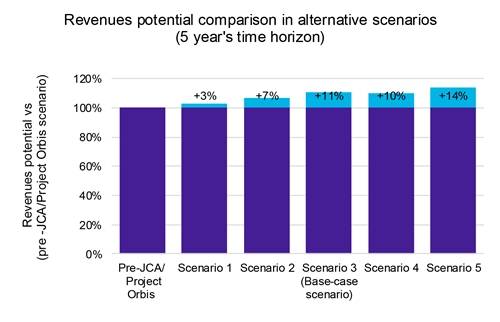
Onze analyse geeft aan dat versnelde productlanceringen weliswaar leiden tot een bescheiden maar merkbare prijserosie (grafiek 1), maar dat de voordelen opwegen tegen de nadelen. Snellere markttoetreding maakt het mogelijk om binnen een korter tijdsbestek een groter marktaandeel te veroveren, wat uiteindelijk de algehele winstgevendheid verhoogt (grafiek 2).
Bovendien onthulde onze analyse van de omzetgevoeligheid in deze scenario's een potentiële omzetstijging van 14%, wat de potentiële financiële voordelen van een versnelde lanceringsstrategie onderstreept.

Sleutel: IRP: internationale referentieprijzen; JCA: Gezamenlijke klinische evaluatie.
Sleutel: JCA: Gezamenlijke klinische evaluatie.
Conclusies
Hoewel snellere prijserosie een overweging blijft, compenseert het toegenomen verkoopvolume dit risico over een periode van 5 jaar. Als gevolg hiervan kunnen fabrikanten die versnelde lanceringsstrategieën toepassen in het kader van JCA en Project Orbis, financiële voordelen behalen en tegelijkertijd zorgen voor een bredere toegang tot levensreddende therapieën.
Beperkingen van onze analyses
De analyse heeft een aantal belangrijke beperkingen:
- Berekening van de opbrengsten: De inkomsten worden geraamd aan de hand van catalogusprijzen in plaats van nettoprijzen, aangezien nettoprijzen voor geneesmiddelen sterk worden beïnvloed door vertrouwelijke overeenkomsten en geheime kortingen. Om consistentie te garanderen, worden potentiële inkomsten beoordeeld op basis van openbaar beschikbare catalogusprijzen.
- Basislijn TTM: De geschatte TTM voor het VK en Zwitserland voorafgaand aan JCA en Project Orbis kan enigszins afwijken van de aannames van deze analyse. Deze variatie ontstaat doordat negen van de 48 producten die werden gebruikt om landspecifieke TTM te beoordelen, werden geëvalueerd via Project Orbis.
- IRP-overwegingen: Er is rekening gehouden met zowel formele als informele IRP-regels. Informele IRP-regels zijn echter moeilijk te evalueren vanwege de inconsistente implementatie. Er werden veronderstellingen gemaakt om in te schatten in hoeverre dit informele prijsbeleid wordt toegepast.
Dit artikel geeft een overzicht van Cencora's begrip van het onderwerp op basis van algemeen beschikbare informatie op het moment van schrijven (zie vermelde bronnen) en de expertise van de auteurs op dit gebied. Aanbevelingen in het artikel zijn mogelijk niet op alle situaties van toepassing en vormen geen juridisch advies; Lezers mogen niet op het artikel vertrouwen bij het nemen van beslissingen met betrekking tot de besproken onderwerpen.
Neem contact op met ons team

Bronnen
- Europese Federatie van Farmaceutische Producten (EFPI). Patiënten W.A.I.T. Indicator 2023 Enquête. Juni 2024. https://efpia.eu/media/vtapbere/efpia-patient-wait-indicator-2024.pdf
- Europese Unie. Gezamenlijke klinische evaluatie van geneesmiddelen. Januari 2025. https://health.ec.europa.eu/document/download/ced91156-ffe1-472d-85eb-aa6a91dd707e_en?filename=hta_htar_factsheet-jca_en.pdf
- Regering van het Verenigd Koninkrijk. Begeleiding bij Project Orbis. Laatst bijgewerkt op 10 januari 2025. https://www.gov.uk/guidance/guidance-on-project-orbis
- Europees Geneesmiddelenbureau. Nationale bevoegde autoriteiten (menselijk). https://www.ema.europa.eu/en/partners-networks/eu-partners/eu-member-states/national-competent-authorities-human
- Wereldbank. Bevolking totaal. Laatst bijgewerkt op 16 december 2024. https://data.worldbank.org/indicator/SP.POP.TOTL
- Kosten van de behandeling. 31 december 2024. Opgehaald uit de Navlin-database.
- Internationale regels voor referentieprijzen. 31 december 2024. Opgehaald uit de Navlin-database.
- Vrdoljak E, Bodoky G, Jassem J, et al. Uitgaven aan oncologische geneesmiddelen en de verhouding tussen sterfte en incidentie door kanker in Centraal- en Oost-Europa. Oncoloog. 2019; 24(1):e30-e37. doi:10.1634 / theoncoloog.2018-0093. https://pmc.ncbi.nlm.nih.gov/articles/PMC6324644/
- Zwitsers medicus. Project Orbis: snellere toegang tot veelbelovende kankerbehandelingen. 29 mei 2024. https://www.swissmedic.ch/swissmedic/en/home/news/mitteilungen/project-orbis-schnellerer-zugang-krebsbehandlungen.html
- Precisie adviseurs. Het post-Brexit Britse toegangslandschap: versnelt Project Orbis de toegang van patiënten tot oncologische geneesmiddelen in het VK aanzienlijk ten opzichte van Europa? 2023. https://www.ispor.org/docs/default-source/intl2023/ispor23kennedyposter-project-orbis-pdf.pdf?sfvrsn=edc15b3_0



