Makale
Kanıt boşluğunu ortaya çıkarmak: Alman sağlık teknolojisi değerlendirmelerinde yetim ilaçlar ve yetim olmayan ilaçlar
Nadir hastalıklar için kullanılan ilaçlar, yasalarca garantili bir ek faydaya sahip oldukları için genellikle kanıt eksikliği konusunda önyargılıdır. Fakat bu önyargı haklı mı? Bu makale, bu kalıcı varsayımların ardındaki gerçeği aydınlatmak için sizi Almanya'daki sağlık teknolojisi değerlendirmesinin aydınlatıcı bir araştırmasına götürüyor.

Alman HTA'da nadir hastalıklar ve tedavileri
Tanımı gereği Avrupa Birliği'nde 2.000 kişiden sadece 1'ini etkileyen nadir hastalıklar, genellikle etkili tedavi seçeneklerinden yoksundur. Yetim ilaçlar (OD'ler) bu boşluğu doldurmaktadır ve bu nedenle geliştirilmeleri ve ticarileştirilmeleri için özel teşvikler almaktadır. Almanya'da pazara erişim için, OD'ler sağlık teknolojisi değerlendirmesinde (HTA) benzersiz bir tedavi görür.
Tıbbi ürünler için Alman HTA'sı, 'Arzneimittelmarktneuordnungsgesetz' (İlaç Piyasasının Yeniden Düzenlenmesi Yasası, AMNOG) tarafından düzenlenmektedir. AMNOG, ilaç üreticileri için geri ödeme ile ulusal sağlık sistemi için harcama yükünü dengelemeyi amaçlamaktadır. Tıbbi ürünlerin, mevcut bir standart tedaviye (uygun karşılaştırmalı tedavi [ACT]olarak adlandırılır) kıyasla bir fayda değerlendirmesinden geçmesi zorunludur. Almanya'da yeni ruhsatlandırılmış bir tıbbi ürünün yeni bir aktif madde ile piyasaya sürülmesi veya halihazırda değerlendirilmiş bir ilacın yeni onaylanmış endikasyonları için bir fayda değerlendirmesi zorunludur. Klinik kanıtlara dayanarak, Federal Ortak Komite (G-BA), eklenen tıbbi faydayı altı kategori ('büyük', 'önemli', 'küçük', 'ölçülemez', 'ek fayda yok' veya 'daha az') kullanarak değerlendirir.
OD'ler için, kanunen ek bir tıbbi yardım sağlanır ve kapsam değerlendirmesi, bir ACT ile karşılaştırma yükümlülüğü olmaksızın önemli kanıtlara dayanır. Ancak, satışlar 30 milyon Euro'ya ulaşırsa veya gösterge yetim statüsünü kaybederse, standart değerlendirme süreci kapsamında yeniden değerlendirme zorunlu hale gelir. Düzenli fayda değerlendirmesine tabi tutulan yetim olmayan ilaçlar (OD olmayanlar) da, geçici kararlar alınması durumunda zorunlu olarak (örneğin, G-BA tarafından ek veriler talep edilirse) veya ilaç üreticisinin talebi üzerine yeniden değerlendirmeye tabi tutulabilir.
Fayda değerlendirmesi, ilaç üreticisi ile Ulusal Yasal Sağlık Sigortası Fonları Birliği (GKV-SV) arasındaki geri ödeme için fiyat müzakeresinin temelini oluşturur. Yalnızca ek tıbbi faydası olan ilaçlar, fiyat pazarlığında ACT'nin maliyetlerinden daha yüksek bir fiyat elde edebilir. Lansmandan sonraki ilk altı ay içinde, üretici lansman fiyatını belirlemekte özgürken, müzakere edilen fiyat yedinci aydan itibaren uygulanır. Bir ilacın geri ödeme fiyatı, ilgili ilaç için yeniden değerlendirmeler ve yeni endikasyonlar HTA'dan ve müteakip fiyat müzakerelerinden geçtiğinde zamanla daha da değişebilir.
Bu makale, OD'ler ve OD olmayanlar arasındaki kanıt kriterlerinin ve fiyatlandırmanın karşılaştırılmasına odaklanan (hem ilk değerlendirme hem de yeniden değerlendirme için) Alman HTA'larının derinlemesine analizinin sonuçlarını araştırmakta ve OD'lerin OD olmayanlara kıyasla HTA'da kanıt eksikliği olup olmadığına ışık tutmayı amaçlamaktadır.
Kapsamlı bir inceleme, 2011'den Mayıs 2024'e kadar OD'ler ve OD olmayanlar için fayda değerlendirmelerini G-BA verilerinden oluşan bir veritabanından analiz etti. Bu analiz 959 fayda değerlendirmesini içeriyordu. Bunlardan 810'u yeni yetkilendirilmiş ilaçların veya bir ilacın yeni yetkilendirilmiş endikasyonlarının ilk değerlendirmeleriyken, 149'u yeniden değerlendirmelerdi ve bazı ürünler ilgili bir endikasyon için birden fazla kez yeniden değerlendirildi. 810 ilk fayda değerlendirmesinin analizi, değerlendirmelerin %27'sinin OD'leri değerlendirdiğini, %73'ünün ise OD olmadığını ortaya koydu. Toplamda, tüm değerlendirmelerin %15'i (%7 OD ve %8 OD olmayan) için yeniden değerlendirme yapılmıştır.
Herhangi bir yeniden değerlendirme, varsa, aynı ilaç için ilgili değerlendirmeleri hizalamak için ilgili ilk fayda değerlendirmesi ile eşleştirildi. OD'ler ve OD olmayanlar için veriler, değerlendirilen kanıtlar (çalışma türleri, çalışma sayısı ve çalışmaların büyüklüğü), verilen ek fayda düzeyi ve fiyat gibi parametrelere odaklanarak çıkarıldı. Değerlendirmeler, ilk değerlendirme ile yeniden değerlendirme arasında kanıt, fayda düzeyi ve fiyatın değişip değişmediğini değerlendirmek için belirli bir endikasyon için hem ilk değerlendirme (60 OD ve 64 OD olmayan) hem de yeniden değerlendirme (54 OD ve 70 OD olmayan) vakalara odaklanmıştır, bu da bazı ilaçların yaygınlık perspektifinden OD statüsünü kaybettiğini ve standart prosedür kapsamında OD olmayan olarak yeniden değerlendirildiğini yansıtmaktadır. ve OD'ler ile OD olmayanlar arasında karşılaştırma yapmak için.
OD'ler için, kanunen ek bir tıbbi yardım sağlanır ve kapsam değerlendirmesi, bir ACT ile karşılaştırma yükümlülüğü olmaksızın önemli kanıtlara dayanır. Ancak, satışlar 30 milyon Euro'ya ulaşırsa veya gösterge yetim statüsünü kaybederse, standart değerlendirme süreci kapsamında yeniden değerlendirme zorunlu hale gelir. Düzenli fayda değerlendirmesine tabi tutulan yetim olmayan ilaçlar (OD olmayanlar) da, geçici kararlar alınması durumunda zorunlu olarak (örneğin, G-BA tarafından ek veriler talep edilirse) veya ilaç üreticisinin talebi üzerine yeniden değerlendirmeye tabi tutulabilir.
Fayda değerlendirmesi, ilaç üreticisi ile Ulusal Yasal Sağlık Sigortası Fonları Birliği (GKV-SV) arasındaki geri ödeme için fiyat müzakeresinin temelini oluşturur. Yalnızca ek tıbbi faydası olan ilaçlar, fiyat pazarlığında ACT'nin maliyetlerinden daha yüksek bir fiyat elde edebilir. Lansmandan sonraki ilk altı ay içinde, üretici lansman fiyatını belirlemekte özgürken, müzakere edilen fiyat yedinci aydan itibaren uygulanır. Bir ilacın geri ödeme fiyatı, ilgili ilaç için yeniden değerlendirmeler ve yeni endikasyonlar HTA'dan ve müteakip fiyat müzakerelerinden geçtiğinde zamanla daha da değişebilir.
Bu makale, OD'ler ve OD olmayanlar arasındaki kanıt kriterlerinin ve fiyatlandırmanın karşılaştırılmasına odaklanan (hem ilk değerlendirme hem de yeniden değerlendirme için) Alman HTA'larının derinlemesine analizinin sonuçlarını araştırmakta ve OD'lerin OD olmayanlara kıyasla HTA'da kanıt eksikliği olup olmadığına ışık tutmayı amaçlamaktadır.
Kapsamlı bir inceleme, 2011'den Mayıs 2024'e kadar OD'ler ve OD olmayanlar için fayda değerlendirmelerini G-BA verilerinden oluşan bir veritabanından analiz etti. Bu analiz 959 fayda değerlendirmesini içeriyordu. Bunlardan 810'u yeni yetkilendirilmiş ilaçların veya bir ilacın yeni yetkilendirilmiş endikasyonlarının ilk değerlendirmeleriyken, 149'u yeniden değerlendirmelerdi ve bazı ürünler ilgili bir endikasyon için birden fazla kez yeniden değerlendirildi. 810 ilk fayda değerlendirmesinin analizi, değerlendirmelerin %27'sinin OD'leri değerlendirdiğini, %73'ünün ise OD olmadığını ortaya koydu. Toplamda, tüm değerlendirmelerin %15'i (%7 OD ve %8 OD olmayan) için yeniden değerlendirme yapılmıştır.
Herhangi bir yeniden değerlendirme, varsa, aynı ilaç için ilgili değerlendirmeleri hizalamak için ilgili ilk fayda değerlendirmesi ile eşleştirildi. OD'ler ve OD olmayanlar için veriler, değerlendirilen kanıtlar (çalışma türleri, çalışma sayısı ve çalışmaların büyüklüğü), verilen ek fayda düzeyi ve fiyat gibi parametrelere odaklanarak çıkarıldı. Değerlendirmeler, ilk değerlendirme ile yeniden değerlendirme arasında kanıt, fayda düzeyi ve fiyatın değişip değişmediğini değerlendirmek için belirli bir endikasyon için hem ilk değerlendirme (60 OD ve 64 OD olmayan) hem de yeniden değerlendirme (54 OD ve 70 OD olmayan) vakalara odaklanmıştır, bu da bazı ilaçların yaygınlık perspektifinden OD statüsünü kaybettiğini ve standart prosedür kapsamında OD olmayan olarak yeniden değerlendirildiğini yansıtmaktadır. ve OD'ler ile OD olmayanlar arasında karşılaştırma yapmak için.

OD'ler ve OD olmayanlar için sunulan kanıtların karşılaştırılabilirliği
OD'ler için, yasalarca otomatik olarak ek bir avantaj sağlanır. Bu nedenle, fayda değerlendirmelerinde OD'ler için hangi klinik kanıtlar sunulmaktadır ve OD olmayan değerlendirmelerden farkı nedir? Standart fayda değerlendirmelerinde ilk adım olarak, G-BA, yeterince güvenilir bir bilgi düzeyi sağlamak için sunulan çalışmaların kalitesini kanıt düzeyine göre değerlendirir. Bu değerlendirmeden yola çıkarak çalışma değerlendirmede ya kabul edilir ya da dikkate alınmaz. Ayrıca, standart bir fayda değerlendirmesi için sağlanan çalışmalar, tıbbi ürünün G-BA tarafından tanımlanan ACT ile karşılaştırılmasını içermelidir. OD'ler, ilk değerlendirmeler için kanıt kriterlerinin daha az katı bir şekilde uygulanmasından yararlanırken, satış limitini aşanlar, yaygınlık açısından yetim statüsünü korusalar bile standart prosedür kapsamında yeniden değerlendirilir.
Değerlendirmeler, kanıtların altın standardı olan randomize kontrollü çalışmaların (RCT'ler) hem OD'ler hem de OD olmayanlar için baskın çalışma türü olduğunu göstermiştir (Şekil 1). OD olmayanlar için, yeniden değerlendirmede (51/70 vaka, %73) G-BA tarafından ilk değerlendirmeye (44/64 vaka, %69) göre daha fazla RCT kabul edilirken, OD'ler için tam tersi olmuştur (45/60 ilk değerlendirme, %75; 35/54 yeniden değerlendirme, %65).
Başlangıçta, üretici tarafından sunulan klinik çalışmalar, tüm OD değerlendirmelerinde G-BA tarafından kabul edildi; çalışmaların çoğunluğu (45/60 vaka, %75) RKÇ ve %25'i (15/60 vaka, %25) RKÇ değildi (ör. tek kollu denemeler, küçük çalışma boyutları, vekil sonuçların kullanımı). OD'ler standart bir fayda değerlendirmesinde yeniden değerlendirildiğinde, satış limitini aştığında, kabul edilen RCT'lerin ve RCT olmayanların oranı sırasıyla %65'e (35/54 yeniden değerlendirme) ve %13'e (7/54 yeniden değerlendirme) düşmüştür. OD yeniden değerlendirmelerinin 12'sinde (%22), ilgili çalışmalar G-BA tarafından kabul edilmemiştir ve bu da standart değerlendirme süreci kapsamında uygulanan daha katı kanıt kriterlerini yansıtmaktadır. ACT'ye uymamak bu değişimin ana nedeni olabilir.
OD'lerin aksine, OD olmayan fayda değerlendirmelerinde çok az sayıda RCT olmayan kabul edildi (2/64 ilk değerlendirme; 1/70 yeniden değerlendirme). Bu nedenle, RCT olmayanların OD'ler için OD olmayanlara göre kabul edilme olasılığı daha yüksek görünmektedir. Ayrıca, üreticinin kanıtları tüm OD ilk değerlendirmelerinde kabul edilirken, sunulan çalışmalar 18 değerlendirmede ve OD olmayanların yeniden değerlendirilmesinde reddedildi. Bunun nedeni, OD değerlendirmelerinde önemli çalışmaların her zaman yasalarca kabul edilmesidir.
Şekil 1. İlk değerlendirmede (IA) ve yeniden değerlendirmede (RA) OD'ler ve OD olmayanlar arasında çalışma türünün dağılımı
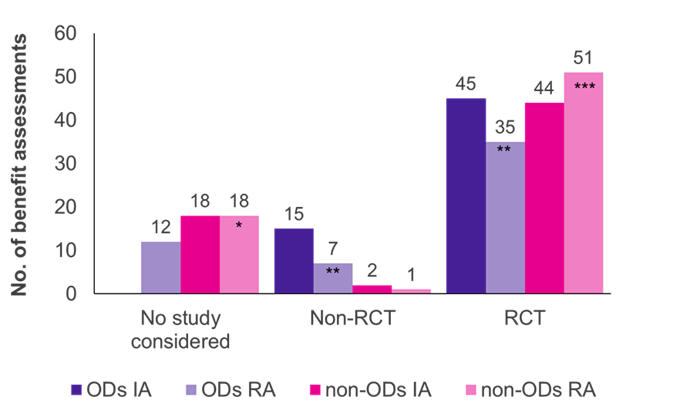
Anahtar: IA – ilk değerlendirme; Hayır. –sayı; OD – yetim ilaç; RA – yeniden değerlendirme; RCT – randomize kontrollü çalışma.
Ayrıca, şaşırtıcı olmayan bir şekilde, artan çalışma popülasyonu büyüklüğü ile bir RCT'nin mevcudiyeti arasında pozitif bir korelasyon vardı (veriler gösterilmemiştir).
Başlangıçta, üretici tarafından sunulan klinik çalışmalar, tüm OD değerlendirmelerinde G-BA tarafından kabul edildi; çalışmaların çoğunluğu (45/60 vaka, %75) RKÇ ve %25'i (15/60 vaka, %25) RKÇ değildi (ör. tek kollu denemeler, küçük çalışma boyutları, vekil sonuçların kullanımı). OD'ler standart bir fayda değerlendirmesinde yeniden değerlendirildiğinde, satış limitini aştığında, kabul edilen RCT'lerin ve RCT olmayanların oranı sırasıyla %65'e (35/54 yeniden değerlendirme) ve %13'e (7/54 yeniden değerlendirme) düşmüştür. OD yeniden değerlendirmelerinin 12'sinde (%22), ilgili çalışmalar G-BA tarafından kabul edilmemiştir ve bu da standart değerlendirme süreci kapsamında uygulanan daha katı kanıt kriterlerini yansıtmaktadır. ACT'ye uymamak bu değişimin ana nedeni olabilir.
OD'lerin aksine, OD olmayan fayda değerlendirmelerinde çok az sayıda RCT olmayan kabul edildi (2/64 ilk değerlendirme; 1/70 yeniden değerlendirme). Bu nedenle, RCT olmayanların OD'ler için OD olmayanlara göre kabul edilme olasılığı daha yüksek görünmektedir. Ayrıca, üreticinin kanıtları tüm OD ilk değerlendirmelerinde kabul edilirken, sunulan çalışmalar 18 değerlendirmede ve OD olmayanların yeniden değerlendirilmesinde reddedildi. Bunun nedeni, OD değerlendirmelerinde önemli çalışmaların her zaman yasalarca kabul edilmesidir.
Şekil 1. İlk değerlendirmede (IA) ve yeniden değerlendirmede (RA) OD'ler ve OD olmayanlar arasında çalışma türünün dağılımı

Anahtar: IA – ilk değerlendirme; Hayır. –sayı; OD – yetim ilaç; RA – yeniden değerlendirme; RCT – randomize kontrollü çalışma.
Not: Başlangıçta OD olarak değerlendirilen altı OD, OD statüsünün kaybı nedeniyle OD olmayan olarak yeniden değerlendirildi (*dört eski OD eklendi; **üç eski OD azaltıldı; ***iki eski OD eklendi).
Ayrıca, şaşırtıcı olmayan bir şekilde, artan çalışma popülasyonu büyüklüğü ile bir RCT'nin mevcudiyeti arasında pozitif bir korelasyon vardı (veriler gösterilmemiştir).
İlk değerlendirmede OD'ler ve OD olmayanlar için verilen ek faydaların dağıtımı
Verilen ek faydanın derecesi, sağlanan kanıtlarla bağlantılıdır. Dikkate değer bir şekilde, 'ek fayda yok' verilmesi, fayda değerlendirmesindeki OD'ler için geçerli değildir ve varsayılan ek tıbbi fayda derecesi 'ölçülemez'dir. OD ilk değerlendirmelerinin çoğu 'ölçülemez' bir fayda ile sonuçlanır (Şekil 2). OD olmayanlar için en çok atanan fayda kategorisi 'ek fayda yok' idi. Verilen bir ek faydanın 'önemli' ve 'küçük' kategorilerdeki dağılımı, OD ve OD olmayan ilk değerlendirmelerde aşağı yukarı karşılaştırılabilirdi.
Şekil 2. İlk değerlendirmelerde ek fayda sağlandı

Şekil 2. İlk değerlendirmelerde ek fayda sağlandı

Anahtar: Hayır. –sayı; OD – yetim ilaç.
Fayda değerlendirmeleri, geri ödeme fiyatlarında bir düşüşe neden olur (OD'lere ve OD olmayanlara benzer)
Fayda değerlendirmesinden önce ve fiyat pazarlığından sonra fiyat seviyelerinin analizi, ilk değerlendirme prosedürü yoluyla lansman fiyatında bir indirim olduğunu gösterdi (OD: %18 indirim; OD dışı: %22 indirim). Yeniden değerlendirme, daha az ölçüde de olsa indirimde daha fazla artışa yol açtı (hem OD'ler hem de OD olmayanlar için yeniden değerlendirmeden sonra %8 indirim). OD'ler ve OD olmayanlar arasındaki fiyat farkı büyüktür. Ortalama olarak, OD'lerin OD olmayanlara göre yaklaşık 10.2 ila 13.5 kat daha pahalı olduğu bulundu. Bu maliyet farkı, lansman sırasında, ilk fayda değerlendirmesinden sonra ve yeniden değerlendirmeler arasında devam etti (veriler gösterilmemiştir).

Yetim ilaçlar: Yüksek maliyetleri güçlü kanıtlarla dengelemek
Analiz, OD olmayanlara göre tipik olarak daha yüksek fiyatlara ve daha az sağlam kanıtlara sahip OD'lerin Alman sağlık sisteminde nasıl değerlendirildiğini gösterdi. OD'ler, fayda değerlendirmelerinin küçük bir bölümünü oluştururken, OD olmayanlara kıyasla yüksek geri ödeme fiyatlarının yansıttığı önemli harcamaları, sağlık sistemi üzerindeki önemli etkilerinin altını çizmektedir. OD'lerin yüksek maliyeti, özellikle kısıtlı hasta popülasyonu ve önemli araştırma ve geliştirme yatırımları olmak üzere birçok faktörden etkilenir. Özellikle, OD'lerin yüksek maliyetleri, özellikle sağlık sistemleri üzerindeki ekonomik yük göz önüne alındığında, fiyatlarının sağlanan kanıtlarla ilgili olarak haklı olup olmadığı açısından tekrar tekrar tartışılmaktadır.
Analizler, sunulan kanıtlarda karşılaştırılabilirliği gösterdi ve RCT'ler hem OD'ler hem de OD olmayanlar için değerlendirmelerin çoğu için kanıt temeli sağladı. Verilerin gösterdiği gibi, OD durumu, tartışmalara konu olan kanıt kalitesi eksikliği ile mutlaka ilişkili değildir. Bununla birlikte, yeniden değerlendirmede OD'ler için kabul edilen çalışmalardaki azalma, ACT'yi ele almanın zorluklarını vurgulamaktadır. Beklendiği gibi, nadir hastalıklarla ilişkili küçük prevalans, kapsamlı RKÇ'lerin yürütülmesinde zorluklara yol açmakta ve hastalık prevalansı ile kanıt kalitesi arasındaki ilişkiyi vurgulamaktadır. Bununla birlikte, ilaç şirketlerinin, yukarıda belirtilen kısıtlamalara rağmen, OD'ler için yürütülen önemli sayıda RCT ile yüksek kaliteli kanıtlar sunduğu gösterilmiştir.
Sonuç olarak, nadir hastalıklar için geliştirilen ilaçlar, üreticiler ve STD yetkilileri için farklı zorluklar ortaya koymaktadır. 'Değerlendirme ayrıcalıkları' tedavisi zor nadir durumlar için tedavilerin kullanılabilirliğini artırırken, kanıta dayalı tıp kriterleri uygulandığında dikkatli olunması gerekir. Bulgularımız, OD'lerin karşılaştığı engellere rağmen, RCT'ler şeklinde yüksek kaliteli kanıtların sağlandığını göstermektedir. Bununla birlikte, HTA sistemi, nadir hastalıklar alanında RKÇ'lerin ara sıra fizibilitesini kabul ederken, OD değerlendirmelerinde RKÇ olmayanların kabul edilmesinde daha fazla hareket alanı sağlar.
Bu makale, OD'lerin yüksek fiyatlarının gerekçesini, etkinlik korelasyonunu veya verilen ek faydanın arkasındaki mantığı incelememiş olsa da, bu temel yönleri ve Alman sağlık sistemi içindeki karmaşıklıklarını analiz etmek için daha fazla değerlendirme yapılması gerekmektedir. OD'lerin maliyetleri, sundukları kanıtların gücü ve sağlık sistemlerine getirdikleri değer arasındaki etkileşim, sürekli inceleme ve analiz gerektiren karmaşık ve gelişen bir konu olmaya devam etmektedir.
Sonuç olarak, nadir hastalıklar için geliştirilen ilaçlar, üreticiler ve STD yetkilileri için farklı zorluklar ortaya koymaktadır. 'Değerlendirme ayrıcalıkları' tedavisi zor nadir durumlar için tedavilerin kullanılabilirliğini artırırken, kanıta dayalı tıp kriterleri uygulandığında dikkatli olunması gerekir. Bulgularımız, OD'lerin karşılaştığı engellere rağmen, RCT'ler şeklinde yüksek kaliteli kanıtların sağlandığını göstermektedir. Bununla birlikte, HTA sistemi, nadir hastalıklar alanında RKÇ'lerin ara sıra fizibilitesini kabul ederken, OD değerlendirmelerinde RKÇ olmayanların kabul edilmesinde daha fazla hareket alanı sağlar.
Bu makale, OD'lerin yüksek fiyatlarının gerekçesini, etkinlik korelasyonunu veya verilen ek faydanın arkasındaki mantığı incelememiş olsa da, bu temel yönleri ve Alman sağlık sistemi içindeki karmaşıklıklarını analiz etmek için daha fazla değerlendirme yapılması gerekmektedir. OD'lerin maliyetleri, sundukları kanıtların gücü ve sağlık sistemlerine getirdikleri değer arasındaki etkileşim, sürekli inceleme ve analiz gerektiren karmaşık ve gelişen bir konu olmaya devam etmektedir.
Kaynak
-
Bundesministerium für Gesundheit (BMG). Seltene Erkrankungen. 2024. Erişim tarihi: 4 Eylül 2024. https://www.bundesgesundheitsministerium.de/themen/praevention/gesundheitsgefahren/seltene-erkrankungen.html
-
Bundesministerium der Justiz (BMJ). Sozialgesetzbuch (SGB) Fünftes Buch (V). Erişim tarihi: 4 Eylül 2024. https://www.gesetze-im-internet.de/sgb_5/__35a.html
-
Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen. Preis- und Kostenentwicklung von Orphan Drugs; Arbeitspapier [online]. 2024. Erişim tarihi: 19 Eylül 2024. https://dx.doi.org/10.60584/GA22-01




