Neue Chancen für Arzneimittel in Europa? Wie sich JCA und Project Orbis auf das Umsatzpotenzial innovativer Arzneimittel auswirken können
JCA und Projekt Orbis: Beschleunigung des Zugangs von Patienten zu onkologischen Behandlungen in ganz Europa


Während umfangreiche Untersuchungen ihre Auswirkungen auf wichtige Branchenfaktoren – wie die Markteinführungszeit (TTM) und die Verfügbarkeit von Medikamenten – untersucht haben, haben ihre finanziellen Auswirkungen, insbesondere ihre Auswirkungen auf den Arzneimittelumsatz, vergleichsweise weniger Aufmerksamkeit erhalten. Das Verständnis dieser kommerziellen Auswirkungen ist von entscheidender Bedeutung, da beschleunigte Genehmigungen und ein breiterer Zugang neue Umsatzmöglichkeiten erschließen und gleichzeitig Preisherausforderungen aufgrund der in Europa üblichen internationalen Referenzpreisgestaltung (IRP) mit sich bringen können.

Überblick über JCA und Project Orbis
JCA wurde entwickelt, um die Wirksamkeit und Sicherheit neuer Produkte durch einen kollaborativen, harmonisierten Ansatz in allen Mitgliedstaaten der Europäischen Union (EU) zu bewerten. Seit Januar 2025 ist JCA für alle Arzneimittel in der Onkologie und bei neuartigen Therapien (ATMPs) verpflichtend. Die von der Europäischen Arzneimittel-Agentur (EMA) für seltene Leiden ausgewiesenen Produkte werden bis 2028 aufgenommen, gefolgt von allen von der EMA registrierten Produkten bis 2030. Diese Initiative wirkt sich direkt auf alle EU27-Mitgliedstaaten, Norwegen und Island aus.
Projekt Orbis
Project Orbis erleichtert die gleichzeitige Einreichung und Prüfung von Onkologieprodukten bei internationalen Zulassungspartnern. Unter der Leitung der US-amerikanischen Food and Drug Administration (FDA) besteht ihr Hauptziel darin, Patienten den Zugang zu innovativen Krebsbehandlungen zu beschleunigen, die klinische Vorteile gegenüber bestehenden Therapien bieten. Zu den teilnehmenden europäischen Zulassungsbehörden gehören die britische Zulassungsbehörde für Arzneimittel und Gesundheitsprodukte (MHRA) und die Schweiz (Swissmedic).

Quantifizierung der Auswirkungen auf den Umsatz
Unser Ansatz verglich die Umsatzprognosen unter einem Pre-JCA- und Project Orbis-Szenario – das traditionelle Regulierungs- und Erstattungspfade darstellt – mit 5 alternativen Startszenarien. Jedes Szenario beinhaltete unterschiedliche Annahmen darüber, wie JCA und Project Orbis TTM in jedem Land und die Umsatzgenerierung beeinflussen.
Szenario vor JCA und Projekt Orbis
Das Umsatzpotenzial vor der Einführung von JCA und Project Orbis wurde auf der Grundlage von 48 Onkologieprodukten geschätzt, die zwischen 2019 und 2022 in Europa zugelassen wurden und nicht am Project Orbis teilnahmen. TTM wurde definiert als die Anzahl der Tage zwischen der Marktzulassung und der Patientenverfügbarkeit in jedem Land. Die Umsatzprognosen über einen Zeitraum von 5 Jahren berücksichtigten die Listenpreise, die Marktgröße und die IRP-Regeln:
- TTM basierte auf dem EFPIA WAIT-Bericht
- Die Listenpreise für jedes Land wurden auf der Grundlage der durchschnittlichen jährlichen Behandlungskosten der Onkologieprodukte ermittelt. Aufgrund der Komplexität der Preisdynamik und der Auswirkungen intransparenter Rabatte stützt sich diese Analyse auf Listenpreise anstelle von Nettopreisen, um eine konsistente Bewertung zu gewährleisten.
- Schätzungen der europäischen Marktgröße unter Berücksichtigung der Bevölkerung und der Pro-Kopf-Ausgaben für die Onkologie.
- IRP-Anwendungen beim Start und nach dem Start nach Daten aus der Navlin IRP-Matrix.
Szenario JCA und Projekt Orbis
Um die Auswirkungen unterschiedlicher Beschleunigungsraten zu bewerten, führten wir eine Sensitivitätsanalyse durch, bei der die Auswirkungen auf den Umsatz der TTM-Beschleunigung zwischen 10 % und 40 % bewertet wurden.
Im Rahmen des Projekts Orbis schätzen wir, dass die Schweiz TTM-Beschleunigungen von bis zu 7 Monaten erleben könnte – eine Annahme, die auf der Einreichungslücke und den Überprüfungszeiten für Onkologieprodukte im Rahmen von Project Orbis im Vergleich zu Nicht-Project Orbis-Pathways in der Schweiz basiert. Wir erwarten jedoch keine Änderungen für das Vereinigte Königreich, da unklar ist, ob der britische Regulierungszeitplan mit Project Orbis wirklich beschleunigt wird. (siehe Tabelle 1).
Tabelle 1. Zusammenfassung des TTM-Szenarios
Szenario |
TTM (Englisch) |
|
Pre-JCA und Projekt Orbis |
Median der TTM der 48 Onkologieprodukte, die zwischen 2019 und 2022 in Europa eingeführt wurden |
|
Szenario 1 |
Vereinigtes Königreich: Keine Änderung der TTM CH: 7 Monate beschleunigte TTM BE, NE, DK, ES: 10% beschleunigte TTM + 100 Tage Andere Länder: 10 % beschleunigte TTM |
|
Szenario 2 |
Vereinigtes Königreich: Keine Änderung der TTM CH: 7 Monate beschleunigte TTM BE, NE, DK, ES: 20% beschleunigte TTM + 100 Tage Andere Länder: 20 % beschleunigtes TTM |
|
Szenario 3 (Basisszenario) |
Vereinigtes Königreich: Keine Änderung der TTM CH: 7 Monate beschleunigte TTM BE, NE, DK, ES: 25 % beschleunigtes TTM-Szenario + 100 Tage Andere Länder: 25 % beschleunigtes TTM |
|
Szenario 4 |
Vereinigtes Königreich: Keine Änderung der TTM CH: 7 Monate beschleunigte TTM BE, NE, DK, ES: 30% beschleunigte TTM + 100 Tage Andere Länder: 30 % beschleunigtes TTM |
|
Szenario 5 |
Vereinigtes Königreich: Keine Änderung der TTM CH: 7 Monate beschleunigte TTM BE, NE, DK, ES: 40% beschleunigte TTM + 100 Tage Andere Länder: 40 % beschleunigte TTM |
Schlüssel: SEIN: Belgien; CH: Schweiz; DK: Dänemark; ES: Spanien; JCA: Gemeinsame klinische Bewertung; NE: Niederlande; TTM: Markteinführungszeit; Vereinigtes Königreich: Vereinigtes Königreich.
Umsatzberechnungen
Mit unserem internen Umsatzrechner haben wir für jedes Szenario eine umfassende 5-Jahres-Umsatzprognose durchgeführt und die Ergebnisse mit dem Szenario vor JCA und Project Orbis verglichen.
Unsere Analyse zeigt, dass beschleunigte Produkteinführungen zwar zu einem bescheidenen, aber spürbaren Preisverfall führen (Grafik 1), die Vorteile jedoch die Nachteile überwiegen. Ein schnellerer Markteintritt ermöglicht die Eroberung eines größeren Marktanteils in kürzerer Zeit, was letztendlich die Gesamtrentabilität steigert (Grafik 2).
Darüber hinaus ergab unsere Umsatzsensitivitätsanalyse für diese Szenarien eine potenzielle Umsatzsteigerung von 14 %, was die potenziellen finanziellen Vorteile einer beschleunigten Markteinführungsstrategie unterstreicht.

Schlüssel: IRP: internationale Referenzpreise; JCA: Gemeinsame klinische Bewertung.
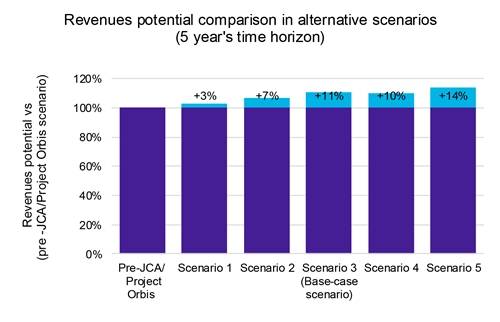
Schlüssel: JCA: Gemeinsame klinische Bewertung.
Schlüsse
Während ein schnellerer Preisverfall nach wie vor eine Überlegung ist, gleicht das gestiegene Verkaufsvolumen dieses Risiko über einen Zeitraum von 5 Jahren aus. Infolgedessen können Hersteller, die im Rahmen von JCA und Project Orbis Strategien für eine beschleunigte Markteinführung anwenden, finanzielle Vorteile erzielen und gleichzeitig einen breiteren Zugang zu lebensrettenden Therapien gewährleisten.
Grenzen unserer Analysen
Die Analyse weist mehrere wichtige Einschränkungen auf:
- Berechnung der Einnahmen: Die Umsatzerlöse werden auf der Grundlage von Listenpreisen und nicht von Nettopreisen geschätzt, da die Nettopreise für Arzneimittel stark von vertraulichen Vereinbarungen und nicht offengelegten Rabatten beeinflusst werden. Um Konsistenz zu gewährleisten, werden potenzielle Einnahmen auf der Grundlage öffentlich verfügbarer Listenpreise bewertet.
- TTM zu Studienbeginn: Die geschätzte TTM für das Vereinigte Königreich und die Schweiz vor JCA und Project Orbis kann leicht von den Annahmen dieser Analyse abweichen. Diese Abweichung ergibt sich daraus, dass neun der 48 Produkte, die zur Bewertung der länderspezifischen TTM verwendet wurden, im Rahmen des Projekts Orbis bewertet wurden.
- IRP-Überlegungen: Sowohl formelle als auch informelle IRP-Regeln wurden berücksichtigt. Informelle IRP-Regeln sind jedoch aufgrund der inkonsistenten Umsetzung schwierig zu bewerten. Es wurden Annahmen getroffen, um abzuschätzen, inwieweit diese informelle Preispolitik angewendet wird.
Dieser Artikel fasst das Verständnis von Cencora zu diesem Thema auf der Grundlage öffentlich zugänglicher Informationen zum Zeitpunkt der Erstellung dieses Artikels (siehe aufgeführte Quellen) und der Expertise der Autoren in diesem Bereich zusammen. Die in diesem Artikel enthaltenen Empfehlungen sind möglicherweise nicht auf alle Situationen anwendbar und stellen keine Rechtsberatung dar. Die Leser sollten sich nicht auf den Artikel verlassen, wenn sie Entscheidungen in Bezug auf die besprochenen Themen treffen.
Verbinden Sie sich mit unserem Team

Quellen
- Europäischer Verband für pharmazeutische Produkte (EFPI). Umfrage zum W.A.I.T.-Indikator 2023 für Patienten. Juni 2024. https://efpia.eu/media/vtapbere/efpia-patient-wait-indicator-2024.pdf
- Europäische Union. Gemeinsame klinische Bewertung von Arzneimitteln. Januar 2025. https://health.ec.europa.eu/document/download/ced91156-ffe1-472d-85eb-aa6a91dd707e_en?filename=hta_htar_factsheet-jca_en.pdf
- Regierung des Vereinigten Königreichs. Anleitung zum Projekt Orbis. Letzte Aktualisierung am 10. Januar 2025. https://www.gov.uk/guidance/guidance-on-project-orbis
- Europäischen Arzneimittel-Agentur. Zuständige nationale Behörden (menschlich). https://www.ema.europa.eu/en/partners-networks/eu-partners/eu-member-states/national-competent-authorities-human
- Weltbank. Gesamtbevölkerung. Letzte Aktualisierung am 16. Dezember 2024. https://data.worldbank.org/indicator/SP.POP.TOTL
- Kosten der Behandlung. 31. Dezember 2024. Abgerufen aus der Navlin-Datenbank.
- Internationale Referenzpreisregeln. 31. Dezember 2024. Abgerufen aus der Navlin-Datenbank.
- Vrdoljak E, Bodoky G, Jassem J, et al. Ausgaben für Onkologiemedikamente und das Verhältnis von Krebssterblichkeit zu Inzidenz in Mittel- und Osteuropa. Onkologe. 2019; 24(1):e30-e37. doi:10.1634/theoncologist.2018-0093. https://pmc.ncbi.nlm.nih.gov/articles/PMC6324644/
- Swissmedic. Projekt Orbis: Schnellerer Zugang zu vielversprechenden Krebstherapien. 29. Mai 2024. https://www.swissmedic.ch/swissmedic/en/home/news/mitteilungen/project-orbis-schnellerer-zugang-krebsbehandlungen.html
- Precision Advisors. Die Zugangslandschaft in Großbritannien nach dem Brexit: Beschleunigt Project Orbis den Zugang von Patienten zu Onkologiemedikamenten in Großbritannien im Vergleich zu Europa erheblich? 2023. https://www.ispor.org/docs/default-source/intl2023/ispor23kennedyposter-project-orbis-pdf.pdf?sfvrsn=edc15b3_0



