Článek
Odhalení mezery v důkazech: Léčivé přípravky pro vzácná onemocnění vs. léčivé přípravky pro vzácná onemocnění v hodnocení německých zdravotnických technologií
U léků na vzácná onemocnění se často předpokládá, že postrádají důkazy, protože mají ze zákona zaručený dodatečný přínos. Je však tento předsudek oprávněný? Tento článek vás vezme na poučný průzkum hodnocení zdravotnických technologií v Německu, abyste objasnili realitu, která se skrývá za těmito přetrvávajícími předpoklady.

Vzácná onemocnění a jejich léčba v německém HTA
Vzácná onemocnění, která ze své podstaty postihují pouze 1 z 2 000 lidí v Evropské unii, často postrádají účinné možnosti léčby. Léčivé přípravky pro vzácná onemocnění tuto mezeru vyplňují, a proto dostávají zvláštní pobídky na jejich vývoj a uvádění na trh. Pokud jde o přístup na trh v Německu, ODS se jim dostává jedinečného zacházení v oblasti hodnocení zdravotnických technologií (HTA).
Hodnocení zdravotnických technologií v Německu pro léčivé přípravky je upraveno zákonem o reorganizaci trhu s léčivými přípravky, AMNOG. Cílem AMNOG je vyvážit úhrady pro výrobce léčiv a výdajovou zátěž národního systému zdravotní péče. Léčivé přípravky jsou povinny podstoupit hodnocení přínosu ve srovnání se stávající standardní léčbou (tzv. vhodnou srovnávací léčbou [ACT]). Posouzení přínosu je povinné při uvádění nově registrovaného léčivého přípravku s novou účinnou látkou na trh v Německu nebo při nově registrovaných indikacích již posuzovaného léčivého přípravku. Na základě klinických důkazů posuzuje Federální smíšený výbor (G-BA) přidaný zdravotní přínos pomocí šesti kategorií ("velký", "značný", "menší", "nevyčíslitelný", "žádný přidaný přínos" nebo "menší").
U OD je dodatečný zdravotní přínos přiznán zákonem a posouzení rozsahu je založeno na klíčových důkazech bez povinnosti srovnání s ACT. Pokud však tržby dosáhnou 30 milionů EUR nebo indikace ztratí status sirotka, je opětovné posouzení v rámci standardního procesu hodnocení povinné. Léčivé přípravky, které nejsou vzácné a podléhají pravidelnému hodnocení přínosů, mohou být rovněž podrobeny novému posouzení, a to buď povinně v případě dočasných rozhodnutí (např. G-BA si vyžádá další údaje), nebo na žádost výrobce léčiv.
Posouzení přínosů je základem pro vyjednávání o ceně úhrady mezi výrobcem léčiv a Národní asociací zákonných zdravotních pojišťoven (GKV-SV). Pouze léky s přidaným léčebným přínosem mohou dosáhnout vyšší ceny, než jsou náklady na ACT při vyjednávání o ceně. Během prvních šesti měsíců po uvedení na trh může výrobce volně definovat zaváděcí cenu, zatímco sjednaná cena se uplatňuje od sedmého měsíce. Cena úhrady léku se může dále měnit s časem, kdy přehodnocení a nové indikace příslušného léku projdou HTA a následným vyjednáváním o ceně.
Tento článek zkoumá výsledky hloubkové analýzy německých hodnocení zdravotnických technologií, která se zaměřuje na srovnání důkazních kritérií a cen mezi OD, a ne-POP (jak pro počáteční posouzení, tak pro přehodnocení), a jeho cílem je objasnit, zda ODS postrádají důkazy o hodnocení zdravotnických technologií ve srovnání s neposkytovanými OD.
V rámci komplexního přezkumu byla analyzována posouzení přínosů pro OD a ostatní od roku 2011 do května 2024 z databáze údajů G-BA. Tato analýza zahrnovala 959 posouzení přínosů. Z toho 810 se jednalo o počáteční hodnocení nově registrovaných léčivých přípravků nebo nově registrovaných indikací léčivého přípravku, zatímco 149 případů se týkalo opakovaného hodnocení, přičemž některé přípravky byly pro příslušnou indikaci přehodnoceny více než jednou. Analýza 810 počátečních posouzení přínosů odhalila, že 27 % hodnocení hodnotilo OD, zatímco 73 % z nich nebyly OD. Celkově bylo přehodnocení provedeno u 15 % všech hodnocení (7 % OD a 8 % non-OD).
Jakékoli přehodnocení bylo v případě potřeby porovnáno s příslušným počátečním posouzením přínosu, aby byla sladěna související hodnocení pro stejný lék. Byly získány údaje pro OD a non-OD, přičemž se zaměřily na parametry, jako jsou posuzované důkazy (typy studií, počet studií a velikost studií), úroveň přiznaného přínosu a cena. Hodnocení se zaměřila jak na případy s počátečním hodnocením (60 OD a 64 ne-OD), tak s opětovným posouzením (54 OD a 70 non-OD, což odráželo, že některé léky ztratily status OD z hlediska prevalence a byly přehodnoceny standardním postupem jako jiné než OD) pro danou indikaci, aby se posoudilo, zda se mezi počátečním posouzením a opětovným posouzením změnily důkazy, úroveň přínosu a cena, a porovnat ODS a non-OD.
U OD je dodatečný zdravotní přínos přiznán zákonem a posouzení rozsahu je založeno na klíčových důkazech bez povinnosti srovnání s ACT. Pokud však tržby dosáhnou 30 milionů EUR nebo indikace ztratí status sirotka, je opětovné posouzení v rámci standardního procesu hodnocení povinné. Léčivé přípravky, které nejsou vzácné a podléhají pravidelnému hodnocení přínosů, mohou být rovněž podrobeny novému posouzení, a to buď povinně v případě dočasných rozhodnutí (např. G-BA si vyžádá další údaje), nebo na žádost výrobce léčiv.
Posouzení přínosů je základem pro vyjednávání o ceně úhrady mezi výrobcem léčiv a Národní asociací zákonných zdravotních pojišťoven (GKV-SV). Pouze léky s přidaným léčebným přínosem mohou dosáhnout vyšší ceny, než jsou náklady na ACT při vyjednávání o ceně. Během prvních šesti měsíců po uvedení na trh může výrobce volně definovat zaváděcí cenu, zatímco sjednaná cena se uplatňuje od sedmého měsíce. Cena úhrady léku se může dále měnit s časem, kdy přehodnocení a nové indikace příslušného léku projdou HTA a následným vyjednáváním o ceně.
Tento článek zkoumá výsledky hloubkové analýzy německých hodnocení zdravotnických technologií, která se zaměřuje na srovnání důkazních kritérií a cen mezi OD, a ne-POP (jak pro počáteční posouzení, tak pro přehodnocení), a jeho cílem je objasnit, zda ODS postrádají důkazy o hodnocení zdravotnických technologií ve srovnání s neposkytovanými OD.
V rámci komplexního přezkumu byla analyzována posouzení přínosů pro OD a ostatní od roku 2011 do května 2024 z databáze údajů G-BA. Tato analýza zahrnovala 959 posouzení přínosů. Z toho 810 se jednalo o počáteční hodnocení nově registrovaných léčivých přípravků nebo nově registrovaných indikací léčivého přípravku, zatímco 149 případů se týkalo opakovaného hodnocení, přičemž některé přípravky byly pro příslušnou indikaci přehodnoceny více než jednou. Analýza 810 počátečních posouzení přínosů odhalila, že 27 % hodnocení hodnotilo OD, zatímco 73 % z nich nebyly OD. Celkově bylo přehodnocení provedeno u 15 % všech hodnocení (7 % OD a 8 % non-OD).
Jakékoli přehodnocení bylo v případě potřeby porovnáno s příslušným počátečním posouzením přínosu, aby byla sladěna související hodnocení pro stejný lék. Byly získány údaje pro OD a non-OD, přičemž se zaměřily na parametry, jako jsou posuzované důkazy (typy studií, počet studií a velikost studií), úroveň přiznaného přínosu a cena. Hodnocení se zaměřila jak na případy s počátečním hodnocením (60 OD a 64 ne-OD), tak s opětovným posouzením (54 OD a 70 non-OD, což odráželo, že některé léky ztratily status OD z hlediska prevalence a byly přehodnoceny standardním postupem jako jiné než OD) pro danou indikaci, aby se posoudilo, zda se mezi počátečním posouzením a opětovným posouzením změnily důkazy, úroveň přínosu a cena, a porovnat ODS a non-OD.

Srovnatelnost předložených důkazů pro ODS a non-ODs
U OD je dodatečná výhoda automaticky přiznána zákonem. Jaké klinické důkazy jsou tedy prezentovány pro OD při hodnocení přínosů a jak se liší od hodnocení bez OD? Jako první krok při standardním hodnocení přínosů posuzuje G-BA kvalitu předložených studií na základě úrovně důkazů, aby byla zajištěna dostatečně spolehlivá úroveň znalostí. Na základě tohoto hodnocení je studie buď přijata, nebo není v hodnocení zohledněna. Studie stanovené pro standardní posouzení přínosu musí dále zahrnovat srovnání léčivého přípravku s ACT definovaným G-BA. Zatímco pro OD platí méně přísná kritéria pro provádění důkazů pro počáteční posouzení, ty, které překračují limit prodeje, jsou znovu posouzeny standardním postupem, a to i v případě, že si z hlediska prevalence zachovávají status osiřelého onemocnění.
Hodnocení ukázala, že randomizované kontrolované studie (RCT), zlatý standard důkazů, byly převládajícím typem studie jak pro OD, tak pro non-OD (obrázek 1). U jiných než OD bylo G-BA přijato více RCT při opětovném posouzení (51/70 případů, 73 %) než při počátečním posouzení (44/64 případů, 69 %), zatímco u OD to bylo naopak (45/60 počátečních hodnocení, 75 %; 35/54 přehodnocení, 65 %).
Zpočátku byly klinické studie předložené výrobcem akceptovány G-BA ve všech hodnoceních OD; většina studií (45/60 případů, 75 %) byla RCT a 25 % (15/60 případů, 25 %) nebyly RCT (např. jednoramenné studie, malé velikosti studií, použití náhradních výsledků). Když byly OD přehodnoceny ve standardním posouzení přínosů a překročily prodejní limit, podíl přijatých RCT a non-RCT se snížil na 65 % (35/54 přehodnocení) a 13 % (7/54 přehodnocení). Ve 12 z přehodnocení OD (22 %) nebyly příslušné studie G-BA přijaty, což odráželo přísnější kritéria důkazů uplatňovaná v rámci standardního procesu hodnocení. Nesplnění ACT může být hlavním důvodem tohoto posunu.
Na rozdíl od OD bylo v posouzení přínosů mimo OD přijato jen velmi málo neRCT (2/64 počáteční hodnocení; 1/70 přehodnocení). Zdá se tedy, že jiné než RCT budou s větší pravděpodobností přijaty pro OD než pro jiné než pro jiné OD. Kromě toho byly důkazy výrobce přijaty ve všech počátečních hodnoceních OD, zatímco předložené studie byly odmítnuty v 18 hodnoceních a opětovných posouzeních jiných než OD. To je způsobeno skutečností, že při hodnocení OD jsou stěžejní studie vždy akceptovány zákonem.
Obrázek 1. Rozdělení typu studie mezi PO a non-OD v počátečním hodnocení (IA) a opětovném hodnocení (RA)
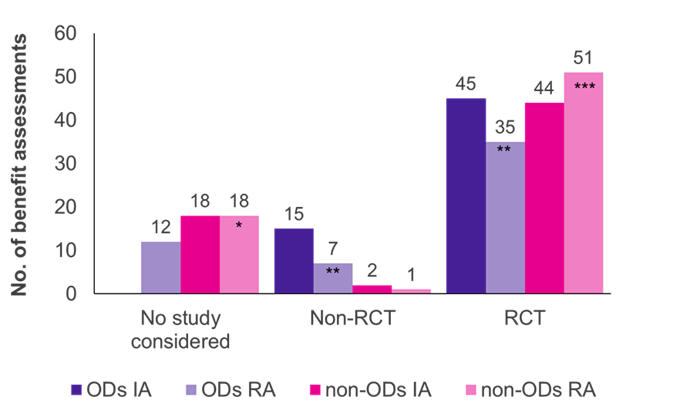
Klíč: IA – počáteční posouzení; Ne. –číslo; OD – léčivý přípravek pro vzácná onemocnění; RA – přehodnocení; RCT – randomizovaná kontrolovaná studie.
Kromě toho, a to není překvapivé, existovala pozitivní korelace mezi zvýšenou velikostí studovaných populací a dostupností RCT (údaje nejsou uvedeny).
Zpočátku byly klinické studie předložené výrobcem akceptovány G-BA ve všech hodnoceních OD; většina studií (45/60 případů, 75 %) byla RCT a 25 % (15/60 případů, 25 %) nebyly RCT (např. jednoramenné studie, malé velikosti studií, použití náhradních výsledků). Když byly OD přehodnoceny ve standardním posouzení přínosů a překročily prodejní limit, podíl přijatých RCT a non-RCT se snížil na 65 % (35/54 přehodnocení) a 13 % (7/54 přehodnocení). Ve 12 z přehodnocení OD (22 %) nebyly příslušné studie G-BA přijaty, což odráželo přísnější kritéria důkazů uplatňovaná v rámci standardního procesu hodnocení. Nesplnění ACT může být hlavním důvodem tohoto posunu.
Na rozdíl od OD bylo v posouzení přínosů mimo OD přijato jen velmi málo neRCT (2/64 počáteční hodnocení; 1/70 přehodnocení). Zdá se tedy, že jiné než RCT budou s větší pravděpodobností přijaty pro OD než pro jiné než pro jiné OD. Kromě toho byly důkazy výrobce přijaty ve všech počátečních hodnoceních OD, zatímco předložené studie byly odmítnuty v 18 hodnoceních a opětovných posouzeních jiných než OD. To je způsobeno skutečností, že při hodnocení OD jsou stěžejní studie vždy akceptovány zákonem.
Obrázek 1. Rozdělení typu studie mezi PO a non-OD v počátečním hodnocení (IA) a opětovném hodnocení (RA)

Klíč: IA – počáteční posouzení; Ne. –číslo; OD – léčivý přípravek pro vzácná onemocnění; RA – přehodnocení; RCT – randomizovaná kontrolovaná studie.
Poznámka: Šest OD, původně posouzených jako OD, bylo přehodnoceno jako non-OD z důvodu ztráty statusu OD (*přidány čtyři bývalé OD; **sníženy o tři bývalé OD; ***přidány dva bývalé OD).
Kromě toho, a to není překvapivé, existovala pozitivní korelace mezi zvýšenou velikostí studovaných populací a dostupností RCT (údaje nejsou uvedeny).
Rozdělení přiznaných dodatečných výhod pro OD a jiné než OD v rámci počátečního posouzení
Míra přiznané přidané výhody je vázána na předložené důkazy. Za zmínku stojí, že přiznání "bez přidané dávky" se při posuzování přínosů nevztahuje na OD a standardní stupeň přidaného zdravotního přínosu je "nevyčíslitelný". Většina počátečních hodnocení OD vede k "nevyčíslitelnému" přínosu (obrázek 2). U osob, které nejsou OD, byla nejčastěji přidělovanou kategorií dávek "žádná přidaná dávka". Rozdělení přiznané přidané výhody v kategoriích "značná" a "malá" byla víceméně srovnatelná v počátečních posouzeních OD i mimo něj.
Obrázek 2. Přiznaná dodatečná výhoda v počátečních hodnoceních

Obrázek 2. Přiznaná dodatečná výhoda v počátečních hodnoceních

Klíč: Ne. –číslo; OD – léčivý přípravek pro vzácná onemocnění.
Posouzení přínosů vede ke snížení cen úhrad (podobně jako u ODS a non-OD)
Analýza cenových hladin před posouzením přínosů a po vyjednávání o ceně ukázala snížení zaváděcí ceny na základě postupu počátečního posouzení (OD: 18% sleva; non-OD: 22% sleva). Přehodnocení vedlo k dalšímu zvýšení rabatu, i když v menší míře (8% sleva po přehodnocení jak pro OD, tak pro non-OD). Cenový rozdíl mezi OD a non-OD je velký. V průměru bylo zjištěno, že OD jsou přibližně 10,2 až 13,5krát dražší než jiné OD. Tento rozdíl v nákladech přetrvával při uvedení na trh, po počátečním posouzení přínosů a napříč opětovným posouzením (údaje nejsou uvedeny).

Léčivé přípravky pro vzácná onemocnění: Vyvážení vysokých nákladů s přesvědčivými důkazy
Analýza ukázala, jak jsou v německém systému zdravotní péče posuzovány OD, které mají obvykle vyšší ceny a méně spolehlivé důkazy než non-OD. I když OD tvoří jen malý zlomek hodnocení dávek, jejich značné náklady, které se odrážejí ve vysokých cenách úhrad ve srovnání s jinými poskytovateli, podtrhují jejich významný dopad na systém zdravotní péče. Zvýšené náklady na ED jsou ovlivněny řadou faktorů, zejména omezeným počtem pacientů a značnými investicemi do výzkumu a vývoje. Zejména vysoké náklady na OD jsou opakovaně diskutovány z hlediska toho, zda je jejich cena oprávněná ve vztahu k poskytnutým důkazům, zejména s ohledem na ekonomickou zátěž zdravotnických systémů.
Analýzy ukázaly srovnatelnost předložených důkazů, přičemž RCT poskytují důkazní základnu pro většinu posouzení jak pro OD, tak pro non-OD. Jak ukazují údaje, status OD nemusí být nutně spojen s nedostatečnou kvalitou důkazů, která byla předmětem diskusí. Snížení počtu schválených studií pro OD v rámci přehodnocení však zdůrazňuje obtíže při řešení ACT. Jak se očekávalo, malá prevalence spojená se vzácnými onemocněními vede k problémům při provádění rozsáhlých RCT, což zdůrazňuje korelaci mezi prevalencí onemocnění a kvalitou důkazů. Ukázalo se však, že farmaceutické společnosti předkládají vysoce kvalitní důkazy, přičemž navzdory výše uvedeným omezením byl pro ODS proveden značný počet RCT.
Závěrem lze říci, že léky vyvinuté pro vzácná onemocnění představují pro výrobce a orgány HTA značné výzvy. Zatímco "privilegia hodnocení" zlepšují dostupnost terapií u obtížně léčitelných vzácných stavů, je třeba opatrnosti, pokud se uplatňují kritéria medicíny založené na důkazech. Naše zjištění ukazují, že navzdory překážkám, s nimiž se OD potýkají, jsou poskytovány vysoce kvalitní důkazy ve formě RCT. Systém hodnocení zdravotnických technologií však uznává občasnou neproveditelnost RCT v oblasti vzácných onemocnění a zároveň ponechává větší volnost při přijímání jiných než RCT při posuzování OD.
I když se tento článek nezabýval ospravedlněním vysokých cen OD, jejich korelací účinnosti nebo zdůvodněním přiznané přidané výhody, je třeba analyzovat tyto klíčové aspekty a jejich složitost v rámci německého systému zdravotní péče. Vzájemný vztah mezi náklady na OD, silou důkazů, které nabízejí, a hodnotou, kterou přinášejí systémům zdravotní péče, zůstává složitým a vyvíjejícím se tématem, které vyžaduje neustálou kontrolu a analýzu.
Závěrem lze říci, že léky vyvinuté pro vzácná onemocnění představují pro výrobce a orgány HTA značné výzvy. Zatímco "privilegia hodnocení" zlepšují dostupnost terapií u obtížně léčitelných vzácných stavů, je třeba opatrnosti, pokud se uplatňují kritéria medicíny založené na důkazech. Naše zjištění ukazují, že navzdory překážkám, s nimiž se OD potýkají, jsou poskytovány vysoce kvalitní důkazy ve formě RCT. Systém hodnocení zdravotnických technologií však uznává občasnou neproveditelnost RCT v oblasti vzácných onemocnění a zároveň ponechává větší volnost při přijímání jiných než RCT při posuzování OD.
I když se tento článek nezabýval ospravedlněním vysokých cen OD, jejich korelací účinnosti nebo zdůvodněním přiznané přidané výhody, je třeba analyzovat tyto klíčové aspekty a jejich složitost v rámci německého systému zdravotní péče. Vzájemný vztah mezi náklady na OD, silou důkazů, které nabízejí, a hodnotou, kterou přinášejí systémům zdravotní péče, zůstává složitým a vyvíjejícím se tématem, které vyžaduje neustálou kontrolu a analýzu.
Zdroje
-
Bundesministerium für Gesundheit (BMG). Seltene Erkrankungen. 2024. Přístup 4. září 2024. https://www.bundesgesundheitsministerium.de/themen/praevention/gesundheitsgefahren/seltene-erkrankungen.html
-
Bundesministerium der Justiz (BMJ). Sozialgesetzbuch (SGB) Fünftes Buch (V). Přístup 4. září 2024. https://www.gesetze-im-internet.de/sgb_5/__35a.html
-
Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen. Preis- und Kostenentwicklung von Orphan Drugs; Arbeitspapier [online]. 2024. Přístup 19. září 2024. https://dx.doi.org/10.60584/GA22-01




