Nuove opportunità per i farmaci in Europa? In che modo JCA e Project Orbis possono influire sul potenziale di reddito dei farmaci innovativi
JCA e Progetto Orbis: Accelerare l'accesso dei pazienti ai trattamenti oncologici in tutta Europa


Sebbene un'ampia ricerca abbia esplorato il loro impatto sui fattori chiave del settore, come il time to market (TTM) e la disponibilità dei farmaci, le loro implicazioni finanziarie, in particolare il loro impatto sui ricavi dei farmaci, hanno ricevuto relativamente meno attenzione. Comprendere questi effetti commerciali è fondamentale, poiché approvazioni accelerate e un accesso più ampio possono sbloccare nuove opportunità di guadagno, introducendo al contempo sfide di prezzo dovute alle pratiche di prezzi di riferimento internazionali (IRP) comunemente applicate in tutta Europa.

Panoramica della JCA e del Progetto Orbis
La JCA è concepita per valutare l'efficacia e la sicurezza dei nuovi prodotti attraverso un approccio collaborativo e armonizzato tra gli Stati membri dell'Unione europea (UE). Da gennaio 2025, la JCA è obbligatoria per tutti i medicinali oncologici e per terapie avanzate (ATMP). I prodotti designati come orfani dell'Agenzia europea per i medicinali (EMA) saranno inclusi entro il 2028, seguiti da tutti i prodotti registrati dall'EMA entro il 2030. Questa iniziativa ha un impatto diretto su tutti gli Stati membri dell'UE-27, sulla Norvegia e sull'Islanda.
Progetto Orbis
Project Orbis facilita la presentazione e la revisione simultanea di prodotti oncologici tra partner normativi internazionali. Guidata dalla Food and Drug Administration (FDA) degli Stati Uniti, il suo obiettivo principale è accelerare l'accesso dei pazienti a trattamenti antitumorali innovativi che offrano vantaggi clinici rispetto alle terapie esistenti. Le autorità di regolamentazione europee partecipanti includono l'Agenzia di regolamentazione dei medicinali e dei prodotti sanitari del Regno Unito (UK) (MHRA) e la Svizzera (Swissmedic).

Quantificare l'impatto sui ricavi
Il nostro approccio ha confrontato le proiezioni dei ricavi in uno scenario pre-JCA e Project Orbis, che rappresenta i tradizionali percorsi normativi e di rimborso, con 5 scenari di lancio alternativi. Ogni scenario incorporava ipotesi diverse su come JCA e Project Orbis influenzano il TTM in ciascun paese e sulla generazione di entrate.
Scenario pre-JCA e Progetto Orbis
Il potenziale di reddito prima dell'introduzione della JCA e del Progetto Orbis è stato stimato sulla base di 48 prodotti oncologici approvati in Europa tra il 2019 e il 2022 che non hanno partecipato al Progetto Orbis. La TTM è stata definita come il numero di giorni che intercorrono tra l'autorizzazione all'immissione in commercio e la disponibilità del paziente in ciascun Paese. Le proiezioni dei ricavi su un periodo di 5 anni hanno considerato i prezzi di listino, le dimensioni del mercato e le regole IRP:
- Il TTM si basava sul rapporto EFPIA WAIT
- I prezzi di listino per ciascun paese sono stati determinati in base al costo medio annuo del trattamento dei prodotti oncologici. A causa della complessità delle dinamiche dei prezzi e dell'impatto di sconti non trasparenti, questa analisi si basa sui prezzi di listino piuttosto che sui prezzi netti per garantire la coerenza nella valutazione.
- Stime delle dimensioni del mercato europeo, considerando la popolazione e la spesa oncologica pro capite.
- Applicazioni IRP al lancio e dopo il lancio, seguendo i dati della matrice Navlin IRP.
Scenario della JCA e del Progetto Orbis
Per valutare l'impatto della variazione dei tassi di accelerazione, abbiamo condotto un'analisi di sensibilità, valutando le implicazioni sui ricavi per l'accelerazione TTM comprese tra il 10% e il 40%.
Nell'ambito del Progetto Orbis, stimiamo che la Svizzera potrebbe sperimentare accelerazioni TTM fino a 7 mesi, un'ipotesi basata sul divario di presentazione e sui tempi di revisione per i prodotti oncologici nell'ambito del Progetto Orbis rispetto ai percorsi non del Progetto Orbis in Svizzera. Tuttavia, non prevediamo alcun cambiamento per il Regno Unito poiché non è chiaro se la tempistica normativa del Regno Unito sia davvero accelerata con Project Orbis. (vedi Tabella 1).
Tabella 1. Riepilogo dello scenario TTM
Scenario |
TTM |
|
Pre-JCA e Progetto Orbis |
Mediana del TTM dei 48 prodotti oncologici lanciati in Europa tra il 2019 e il 2022 |
|
Scenario 1 |
Regno Unito: Nessun cambiamento nel TTM CH: TTM accelerato di 7 mesi BE, NE, DK, ES: TTM accelerato del 10% + 100 giorni Altri paesi: TTM accelerato del 10% |
|
Scenario 2 |
Regno Unito: Nessun cambiamento nel TTM CH: TTM accelerato di 7 mesi BE, NE, DK, ES: TTM accelerato del 20% + 100 giorni Altri paesi: TTM accelerato del 20% |
|
Scenario 3 (scenario di base) |
Regno Unito: Nessun cambiamento nel TTM CH: TTM accelerato di 7 mesi BE, NE, DK, ES: Scenario TTM accelerato del 25% + 100 giorni Altri paesi: TTM accelerato del 25% |
|
Scenario 4 |
Regno Unito: Nessun cambiamento nel TTM CH: TTM accelerato di 7 mesi BE, NE, DK, ES: TTM accelerato del 30% + 100 giorni Altri paesi: TTM accelerato del 30% |
|
Scenario 5 |
Regno Unito: Nessun cambiamento nel TTM CH: TTM accelerato di 7 mesi BE, NE, DK, ES: TTM accelerato del 40% + 100 giorni Altri paesi: TTM accelerato del 40% |
Chiave: ESSERE: Belgio; CH: Svizzera; DK: Danimarca; ES: Spagna; JCA: Valutazione clinica congiunta; NE: Paesi Bassi; TTM: tempo di commercializzazione; Regno Unito: Regno Unito.
Calcolo delle entrate
Utilizzando il nostro calcolatore di entrate interne, abbiamo condotto una proiezione completa delle entrate a 5 anni per ogni scenario e abbiamo confrontato i risultati con lo scenario pre-JCA e Project Orbis.
La nostra analisi indica che, sebbene i lanci di prodotti accelerati portino a un'erosione dei prezzi modesta ma evidente (Grafico 1), i vantaggi superano gli svantaggi. Un ingresso più rapido nel mercato consente di acquisire una quota di mercato maggiore in un lasso di tempo più breve, aumentando in ultima analisi la redditività complessiva (Grafico 2).
Inoltre, la nostra analisi di sensibilità ai ricavi in questi scenari ha rivelato un potenziale aumento dei ricavi del 14%, sottolineando i potenziali vantaggi finanziari di una strategia di lancio accelerata.

Chiave: IRP: prezzi di riferimento internazionali; JCA: Valutazione clinica congiunta.
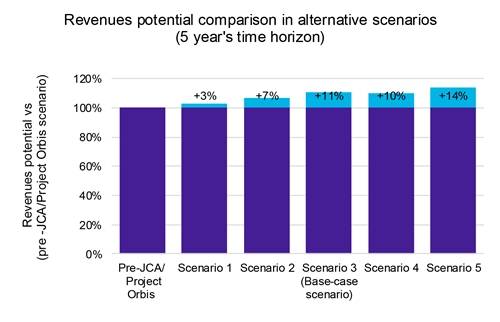
Chiave: JCA: Valutazione clinica congiunta.
Conclusioni
Sebbene l'erosione più rapida dei prezzi rimanga una considerazione, l'aumento del volume delle vendite compensa questo rischio su un periodo di 5 anni. Di conseguenza, i produttori che adottano strategie di lancio accelerate nell'ambito della JCA e del Progetto Orbis otterranno vantaggi finanziari, garantendo al contempo un accesso più ampio alle terapie salvavita.
Limiti delle nostre analisi
L'analisi presenta diverse importanti limitazioni:
- Calcolo delle entrate: I ricavi sono stimati utilizzando i prezzi di listino piuttosto che i prezzi netti, poiché i prezzi netti dei prodotti farmaceutici sono fortemente influenzati da accordi riservati e sconti non divulgati. Per garantire la coerenza, i ricavi potenziali sono valutati in base ai prezzi di listino pubblicamente disponibili.
- TTM di base: Il TTM stimato per il Regno Unito e la Svizzera prima della JCA e del Progetto Orbis potrebbe differire leggermente dalle ipotesi di questa analisi. Questa variazione deriva dal fatto che nove dei 48 prodotti utilizzati per valutare la TTM specifica per paese sono stati valutati attraverso il Progetto Orbis.
- Considerazioni IRP: Sono state prese in considerazione sia le regole IRP formali che informali. Tuttavia, le regole informali dell'IRP sono difficili da valutare a causa dell'implementazione incoerente. Sono state fatte ipotesi per stimare la misura in cui queste politiche informali dei prezzi vengono applicate.
Questo articolo riassume la comprensione dell'argomento da parte di Cencora sulla base delle informazioni pubblicamente disponibili al momento della stesura (si vedano le fonti elencate) e l'esperienza degli autori in questo settore. Eventuali raccomandazioni fornite nell'articolo potrebbero non essere applicabili a tutte le situazioni e non costituiscono una consulenza legale; I lettori non dovrebbero fare affidamento sull'articolo nel prendere decisioni relative agli argomenti discussi.
Mettiti in contatto con il nostro team

Fonti
- Federazione europea dei prodotti farmaceutici (EFPI). Sondaggio sull'indicatore W.A.I.T. 2023 dei pazienti. Giugno 2024. https://efpia.eu/media/vtapbere/efpia-patient-wait-indicator-2024.pdf
- Unione Europea. valutazione clinica congiunta dei medicinali. Gennaio 2025. https://health.ec.europa.eu/document/download/ced91156-ffe1-472d-85eb-aa6a91dd707e_en?filename=hta_htar_factsheet-jca_en.pdf
- Governo del Regno Unito. Guida al Progetto Orbis. Ultimo aggiornamento 10 gennaio 2025. https://www.gov.uk/guidance/guidance-on-project-orbis
- Agenzia europea per i medicinali. Autorità nazionali competenti (umane). https://www.ema.europa.eu/en/partners-networks/eu-partners/eu-member-states/national-competent-authorities-human
- Banca Mondiale. Popolazione totale. Ultimo aggiornamento 16 dicembre 2024. https://data.worldbank.org/indicator/SP.POP.TOTL
- Costo del trattamento. 31 dicembre 2024. Recuperato dal database Navlin.
- Norme internazionali in materia di prezzi di riferimento. 31 dicembre 2024. Recuperato dal database Navlin.
- Vrdoljak E, Bodoky G, Jassem J, et al. Spese per farmaci oncologici e rapporto mortalità/incidenza del cancro nell'Europa centrale e orientale. Oncologo. 2019; 24(1):e30-e37. DOI:10.1634/TheOncologist.2018-0093. https://pmc.ncbi.nlm.nih.gov/articles/PMC6324644/
- Swissmedic. Progetto Orbis: accesso più rapido a trattamenti antitumorali promettenti. 29 maggio 2024. https://www.swissmedic.ch/swissmedic/en/home/news/mitteilungen/project-orbis-schnellerer-zugang-krebsbehandlungen.html
- Consulenti di precisione. Il panorama dell'accesso nel Regno Unito post-Brexit: Project Orbis accelera significativamente l'accesso dei pazienti ai farmaci oncologici nel Regno Unito rispetto all'Europa? 2023. https://www.ispor.org/docs/default-source/intl2023/ispor23kennedyposter-project-orbis-pdf.pdf?sfvrsn=edc15b3_0



