De nouvelles opportunités pour les médicaments en Europe ? Comment la JCA et le projet Orbis peuvent avoir un impact sur le potentiel de revenus des médicaments innovants
JCA et le projet Orbis : Accélérer l’accès des patients aux traitements oncologiques en Europe


Bien que des recherches approfondies aient exploré leur impact sur des facteurs clés de l’industrie, tels que le délai de mise sur le marché (TTM) et la disponibilité des médicaments, leurs implications financières, en particulier leur impact sur les revenus des médicaments, ont reçu comparativement moins d’attention. Il est essentiel de comprendre ces effets commerciaux, car des approbations accélérées et un accès plus large peuvent débloquer de nouvelles opportunités de revenus tout en introduisant des défis en matière de tarification en raison des pratiques internationales de tarification de référence (IRP) couramment appliquées en Europe.

Présentation de la JCA et du projet Orbis
La JCA est conçue pour évaluer l’efficacité et la sécurité des nouveaux produits par le biais d’une approche collaborative et harmonisée entre les États membres de l’Union européenne (UE). Depuis janvier 2025, la JCA est obligatoire pour tous les médicaments d’oncologie et de thérapie innovante (MTI). Les produits orphelins de l’Agence européenne des médicaments (EMA) seront inclus d’ici 2028, suivis de tous les produits enregistrés auprès de l’EMA d’ici 2030. Cette initiative a un impact direct sur tous les États membres de l’UE27, la Norvège et l’Islande.
Projet Orbis
Le projet Orbis facilite la soumission et l’examen simultanés de produits oncologiques entre les partenaires réglementaires internationaux. Dirigé par la Food and Drug Administration (FDA) des États-Unis, son objectif principal est d’accélérer l’accès des patients à des traitements anticancéreux innovants qui offrent des avantages cliniques par rapport aux thérapies existantes. Les autorités réglementaires européennes participantes sont l’Agence de réglementation des médicaments et des produits de santé (MHRA) du Royaume-Uni (RU) et la Suisse (Swissmedic).

Quantifier l’impact sur le chiffre d’affaires
Notre approche a comparé les projections de revenus dans le cadre d’un scénario pré-JCA et du projet Orbis, représentant les voies réglementaires et de remboursement traditionnelles, avec 5 scénarios de lancement alternatifs. Chaque scénario intégrait différentes hypothèses concernant l’influence de la JCA et du projet Orbis sur le TTM dans chaque pays et la génération de revenus.
Scénario pré-JCA et du projet Orbis
Le potentiel de revenus avant l’introduction de JCA et du projet Orbis a été estimé sur la base de 48 produits oncologiques approuvés en Europe entre 2019 et 2022 qui n’ont pas participé au projet Orbis. La TTM a été définie comme le nombre de jours entre l’autorisation de mise sur le marché et la disponibilité des patients dans chaque pays. Les projections de revenus sur une période de 5 ans ont pris en compte les prix catalogue, la taille du marché et les règles IRP :
- TTM était basé sur le rapport EFPIA WAIT
- Les prix catalogue pour chaque pays ont été déterminés en fonction du coût annuel médian de traitement des produits oncologiques. En raison de la complexité de la dynamique des prix et de l’impact des remises non transparentes, cette analyse repose sur les prix courants plutôt que sur les prix nets pour assurer la cohérence de l’évaluation.
- Estimations de la taille du marché européen, en tenant compte de la population et des dépenses d’oncologie par habitant.
- Demandes IRP au lancement et après le lancement, selon les données de la matrice IRP de Navlin.
Scénario JCA et Projet Orbis
Pour évaluer l’impact des différents taux d’accélération, nous avons effectué une analyse de sensibilité, évaluant les implications sur les revenus pour l’accélération TTM allant de 10 % à 40 %.
Dans le cadre du projet Orbis, nous estimons que la Suisse pourrait connaître des accélérations du TTM allant jusqu’à 7 mois, une hypothèse basée sur l’écart de soumission et les délais d’examen des produits oncologiques dans le cadre du projet Orbis par rapport aux voies hors projet Orbis en Suisse. Cependant, nous ne prévoyons aucun changement pour le Royaume-Uni car il n’est pas clair si le calendrier réglementaire britannique est vraiment accéléré avec le projet Orbis. (voir Tableau 1).
Tableau 1. Résumé du scénario TTM
Scénario |
TTM |
|
Pré-JCA et projet Orbis |
Médiane du TTM des 48 produits oncologiques lancés en Europe entre 2019 et 2022 |
|
Scénario 1 |
ROYAUME-UNI: Pas de modification du TTM CH: 7 mois de TTM accéléré BE, NE, DK, ES : TTM accéléré de 10 % + 100 jours Autres pays : Accélération du TTM de 10 % |
|
Scénario 2 |
ROYAUME-UNI: Pas de modification du TTM CH: 7 mois de TTM accéléré BE, NE, DK, ES : TTM accéléré de 20 % + 100 jours Autres pays : Accélération de 20 % du TTM |
|
Scénario 3 (Scénario de référence) |
ROYAUME-UNI: Pas de modification du TTM CH: 7 mois de TTM accéléré BE, NE, DK, ES : Scénario TTM accéléré de 25 % + 100 jours Autres pays : Accélération du TTM de 25 % |
|
Scénario 4 |
ROYAUME-UNI: Pas de modification du TTM CH: 7 mois de TTM accéléré BE, NE, DK, ES : TTM accéléré de 30 % + 100 jours Autres pays : 30 % de TTM accéléré |
|
Scénario 5 |
ROYAUME-UNI: Pas de modification du TTM CH: 7 mois de TTM accéléré BE, NE, DK, ES : 40 % TTM accéléré + 100 jours Autres pays : 40 % de TTM accéléré |
Clé: ÊTRE: Belgique; CH: Suisse; DK: Danemark; ES : Espagne; JCA: Évaluation clinique conjointe ; NE : Pays-Bas ; TTM : délai de mise sur le marché ; ROYAUME-UNI: Royaume-Uni.
Calculs des revenus
À l’aide de notre calculateur de revenus interne, nous avons effectué une projection complète des revenus sur 5 ans pour chaque scénario et comparé les résultats au scénario antérieur à JCA et au projet Orbis.
Notre analyse indique que si l’accélération des lancements de produits entraîne une érosion modeste mais notable des prix (graphique 1), les avantages l’emportent sur les inconvénients. Une entrée plus rapide sur le marché permet de conquérir une plus grande part de marché dans un délai plus court, ce qui stimule en fin de compte la rentabilité globale (graphique 2).
De plus, notre analyse de sensibilité des revenus pour ces scénarios a révélé une augmentation potentielle des revenus de 14 %, soulignant les avantages financiers potentiels d’une stratégie de lancement accéléré.

Clé: IRP : prix de référence international ; JCA: Évaluation clinique conjointe.
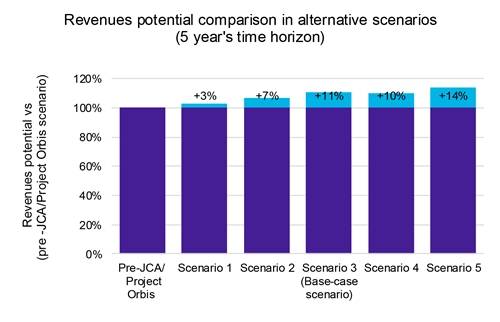
Clé: JCA: Évaluation clinique conjointe.
Conclusions
Bien que l’érosion plus rapide des prix reste à prendre en compte, l’augmentation du volume des ventes compense ce risque sur une période de 5 ans. En conséquence, les fabricants qui adoptent des stratégies de lancement accéléré dans le cadre de la JCA et du projet Orbis bénéficieront d’avantages financiers tout en garantissant un accès plus large aux traitements vitaux.
Limites de nos analyses
L’analyse présente plusieurs limites importantes :
- Calcul des revenus : Les revenus sont estimés à l’aide des prix courants plutôt que des prix nets, car les prix nets des produits pharmaceutiques sont fortement influencés par des accords confidentiels et des remises non divulguées. Par souci d’uniformité, les revenus potentiels sont évalués en fonction des prix courants accessibles au public.
- TTM de base : Le TTM estimé pour le Royaume-Uni et la Suisse avant la JCA et le projet Orbis peut différer légèrement des hypothèses de cette analyse. Cette variation s’explique par le fait que neuf des 48 produits utilisés pour évaluer la TTM par pays ont été évalués dans le cadre du projet Orbis.
- Considérations relatives à l’IRP : Les règles formelles et informelles de l’IRP ont été prises en compte. Cependant, les règles informelles de l’IRP sont difficiles à évaluer en raison de leur mise en œuvre incohérente. Des hypothèses ont été formulées pour estimer la mesure dans laquelle ces politiques de prix informelles sont appliquées.
Cet article résume la compréhension du sujet par Cencora sur la base d’informations accessibles au public au moment de la rédaction (voir les sources énumérées) et de l’expertise des auteurs dans ce domaine. Les recommandations formulées dans l’article peuvent ne pas s’appliquer à toutes les situations et ne constituent pas des conseils juridiques. Les lecteurs ne doivent pas se fier à l’article pour prendre des décisions liées aux sujets abordés.
Entrez en contact avec notre équipe

Sources
- Fédération européenne des produits pharmaceutiques (EFPI). Enquête 2023 sur l’indicateur W.A.I.T. des patients. Juin 2024. https://efpia.eu/media/vtapbere/efpia-patient-wait-indicator-2024.pdf
- Union européenne. Évaluation clinique conjointe des médicaments. Janvier 2025. https://health.ec.europa.eu/document/download/ced91156-ffe1-472d-85eb-aa6a91dd707e_en?filename=hta_htar_factsheet-jca_en.pdf
- Gouvernement du Royaume-Uni. Conseils sur le projet Orbis. Dernière mise à jour le 10 janvier 2025. https://www.gov.uk/guidance/guidance-on-project-orbis
- Agence européenne des médicaments. Autorités nationales compétentes (humaines). https://www.ema.europa.eu/en/partners-networks/eu-partners/eu-member-states/national-competent-authorities-human
- Banque mondiale. Population totale. Dernière mise à jour le 16 décembre 2024. https://data.worldbank.org/indicator/SP.POP.TOTL
- Coût du traitement. 31 décembre 2024. Extrait de la base de données Navlin.
- Règles internationales de tarification de référence. 31 décembre 2024. Extrait de la base de données Navlin.
- Vrdoljak E, Bodoky G, Jassem J, et al. Dépenses en médicaments oncologiques et rapport mortalité/incidence du cancer en Europe centrale et orientale. Oncologue. 2019; 24(1) :e30-e37. doi :10.1634/theoncologist.2018-0093. https://pmc.ncbi.nlm.nih.gov/articles/PMC6324644/
- Swissmedic. Projet Orbis : un accès plus rapide à des traitements prometteurs contre le cancer. 29 mai 2024. https://www.swissmedic.ch/swissmedic/en/home/news/mitteilungen/project-orbis-schnellerer-zugang-krebsbehandlungen.html
- Conseillers de précision. Le paysage de l’accès post-Brexit au Royaume-Uni : le projet Orbis accélère-t-il considérablement l’accès des patients aux médicaments oncologiques au Royaume-Uni par rapport à l’Europe ? 2023. https://www.ispor.org/docs/default-source/intl2023/ispor23kennedyposter-project-orbis-pdf.pdf?sfvrsn=edc15b3_0



