Explorer la logistique et les modalités de la thérapie cellulaire et génique
Mise à jour pour le T3 2024

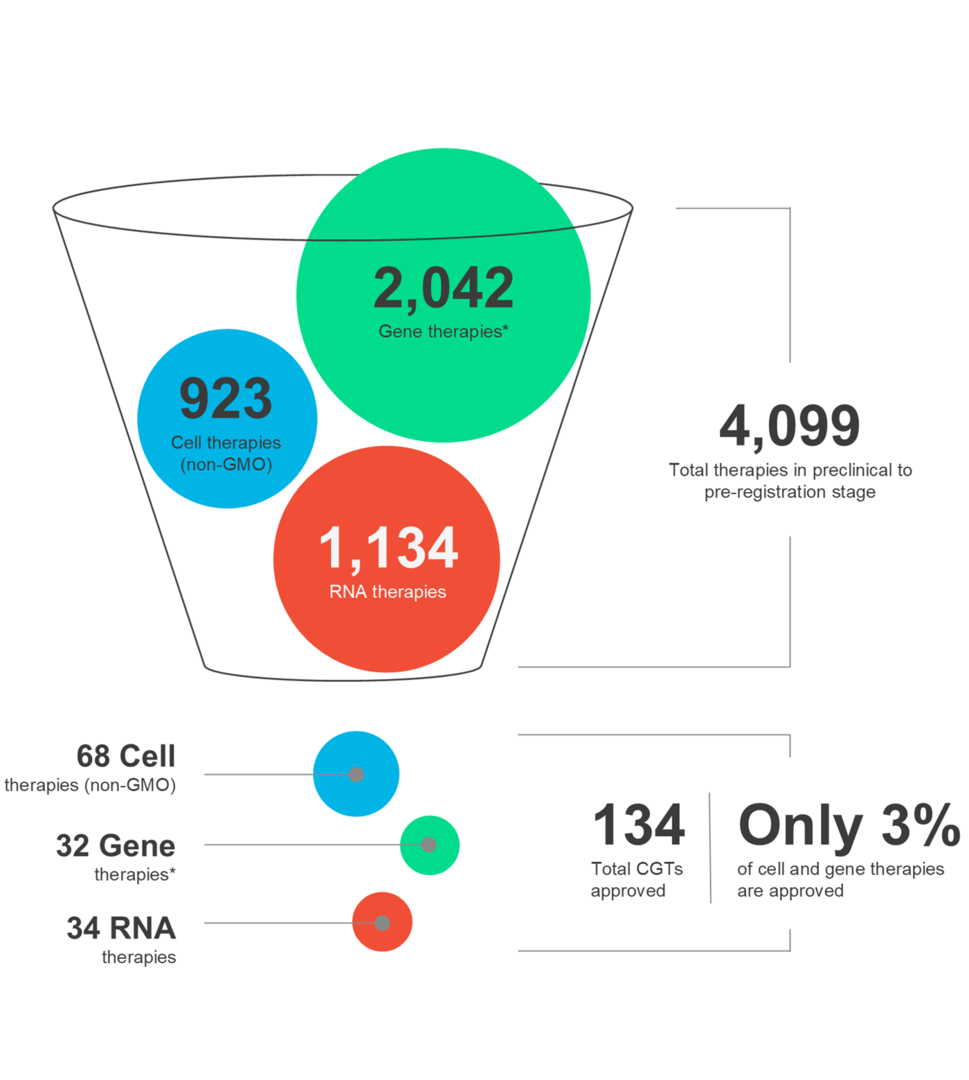
Les thérapies cellulaires et géniques (TCG) façonnent l’avenir de la médecine et offrent un nouvel espoir aux patients du monde entier. Ces thérapies innovantes ont le pouvoir de cibler un large éventail de maladies. Cependant, il est crucial de reconnaître que le paysage de la CGT est dynamique et que le succès thérapeutique nécessite un examen attentif de multiples facteurs tout au long du processus de développement et de distribution des médicaments.
Dans notre dernière infographie, explorez les dernières tendances du marché et les nuances des différentes modalités CGT, ainsi que des thérapies autologues et allogéniques.

FAQ sur le pipeline de développement de thérapies cellulaires
Quelles sont les thérapies cellulaires approuvées ?
Il existe de nombreuses thérapies cellulaires approuvées, en voici quelques exemples :
- Kymirah (tisagenlecleucel): Un type d'immunothérapie connu sous le nom de thérapie cellulaire CAR-T et il est utilisé pour traiter certains types de lymphome non hodgkinien et de leucémie lymphoblastique aiguë
- Yescarta (axicabtagene ciloleucel): Thérapie cellulaire CAR-T utilisée pour traiter les lymphomes à grandes cellules B après deux lignes ou plus de traitement systémique
- Provenge (sipuleucel-T): Immunothérapie cellulaire autologue indiquée pour le traitement du cancer de la prostate métastatique résistant à la castration asymptomatique ou peu symptomatique
Quel est le processus d’approbation des thérapies cellulaires ?
L’approbation de la thérapie cellulaire implique un processus rigoureux supervisé par des organismes de réglementation tels que la Food and Drug Administration (FDA). Cela commence par des essais précliniques en laboratoire et sur des modèles animaux, suivis d’une demande de nouveau médicament expérimental (IND). S’ils sont approuvés, les essais cliniques sont menés en trois phases pour évaluer l’innocuité, l’efficacité et la posologie. Après le procès, une demande de licence de produit biologique (BLA) est soumise pour examen. En cas de succès, la thérapie est approuvée pour la mise sur le marché, mais continue d’être surveillée pour les effets à long terme.
Combien y a-t-il de thérapies cellulaires approuvées ?
Le nombre de thérapies cellulaires approuvées peut varier d’un pays à l’autre, car chacun a ses propres organismes de réglementation et processus d’approbation. Aux États-Unis, les thérapies cellulaires sont réglementées par la FDA, tandis qu’en Europe, elles relèvent de la compétence de l’Agence européenne des médicaments. Ces organismes ont des critères et des échéanciers différents pour l’approbation. De plus, avec les progrès de la recherche médicale et de la technologie, de nouvelles thérapies cellulaires sont développées et testées en permanence. Par conséquent, le nombre de thérapies cellulaires approuvées ne cesse d’augmenter dans le monde entier.




