Utforske celle- og genterapilogistikk og modaliteter
Oppdatert for Q3 2024

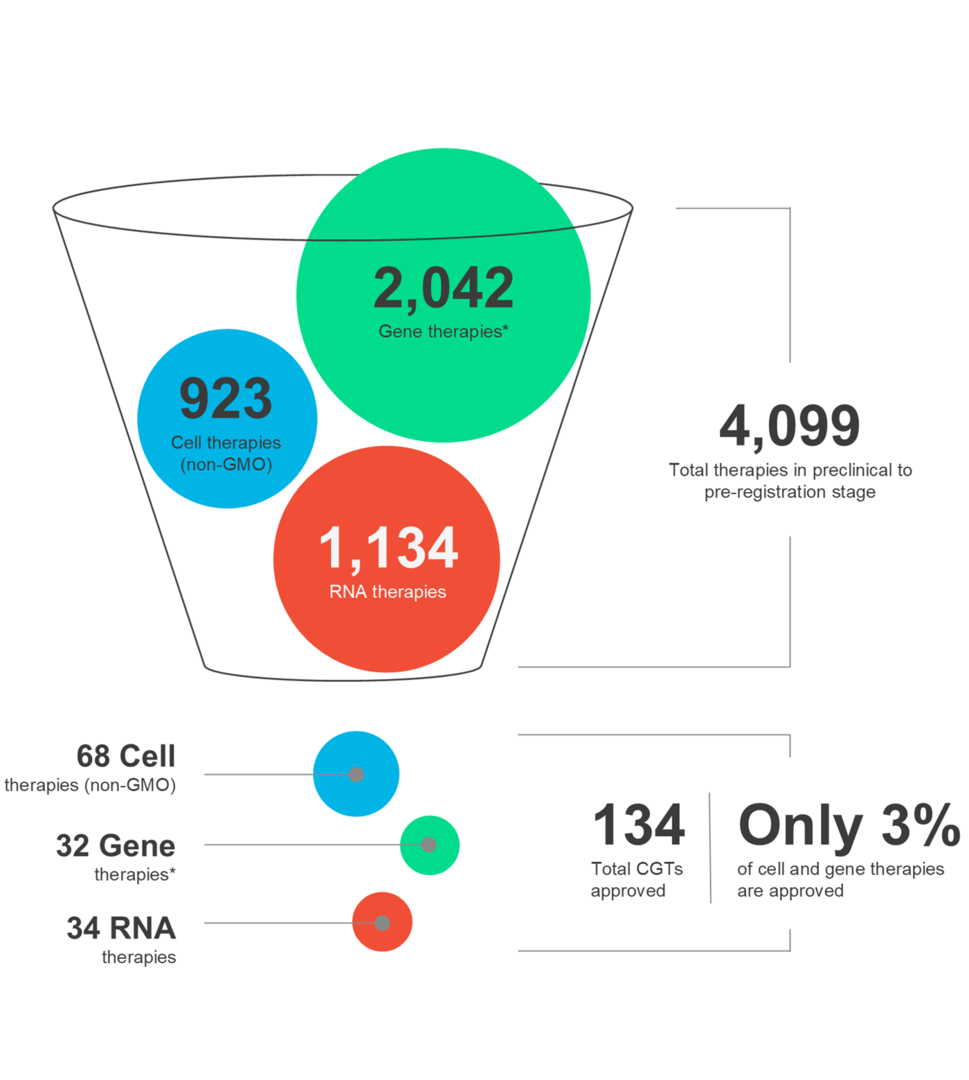
Celle- og genterapier (CGT) former fremtiden for medisin og gir nytt håp til pasienter over hele verden. Disse avanserte terapiene har kraften til å målrette mot et bredt spekter av tilstander. Det er imidlertid avgjørende å erkjenne at CGT-landskapet er dynamisk og terapeutisk suksess krever nøye vurdering av flere faktorer gjennom hele legemiddelutviklings- og distribusjonsprosessen.
I vår siste infografikk kan du utforske de siste markedstrendene og nyansene til ulike CGT-modaliteter, sammen med autologe og allogene terapier.

Vanlige spørsmål om utvikling av celleterapi
Hvilke celleterapier er godkjent?
Det er mange godkjente celleterapier, noen eksempler inkluderer:
- Kymirah (tisagenlecleucel): En type immunterapi kjent som CAR-T-celleterapi, og den brukes til å behandle visse typer ikke-Hodgkins lymfom og akutt lymfatisk leukemi
- Yescarta (axicabtagene ciloleucel): En CAR-T-celleterapi som brukes til behandling av store B-celle lymfomer etter to eller flere linjer med systemisk terapi
- Provenge (sipuleucel-T): En autolog cellulær immunterapi indisert for behandling av asymptomatisk eller minimalt symptomatisk metastatisk kastratresistent prostatakreft
Hva er godkjenningsprosessen for celleterapi?
Godkjenning av celleterapi innebærer en streng prosess overvåket av reguleringsorganer som Food and Drug Administration (FDA). Det begynner med preklinisk testing i laboratorier og dyremodeller, etterfulgt av en undersøkelsesapplikasjon for nytt medikament (IND). Hvis godkjent, gjennomføres kliniske studier i tre faser for å vurdere sikkerhet, effekt og dosering. Etter rettssaken sendes en Biologics License Application (BLA) inn for gjennomgang. Hvis den lykkes, er behandlingen godkjent for markedet, men fortsetter å bli overvåket for langtidseffekter.
Hvor mange godkjente celleterapier finnes det?
Antall godkjente celleterapier kan variere fra land til land, da hver har sine egne reguleringsorganer og godkjenningsprosesser. I USA er celleterapier regulert av FDA, mens de i Europa faller inn under ansvarsområdet til European Medicines Agency. Disse byråene har forskjellige kriterier og tidslinjer for godkjenning. Videre, med fremskritt innen medisinsk forskning og teknologi, utvikles og testes nye celleterapier kontinuerlig. Følgelig vokser antallet godkjente celleterapier jevnt over hele verden.




