Erforschung der Logistik und Modalitäten von Zell- und Gentherapien
Aktualisiert für Q3 2024

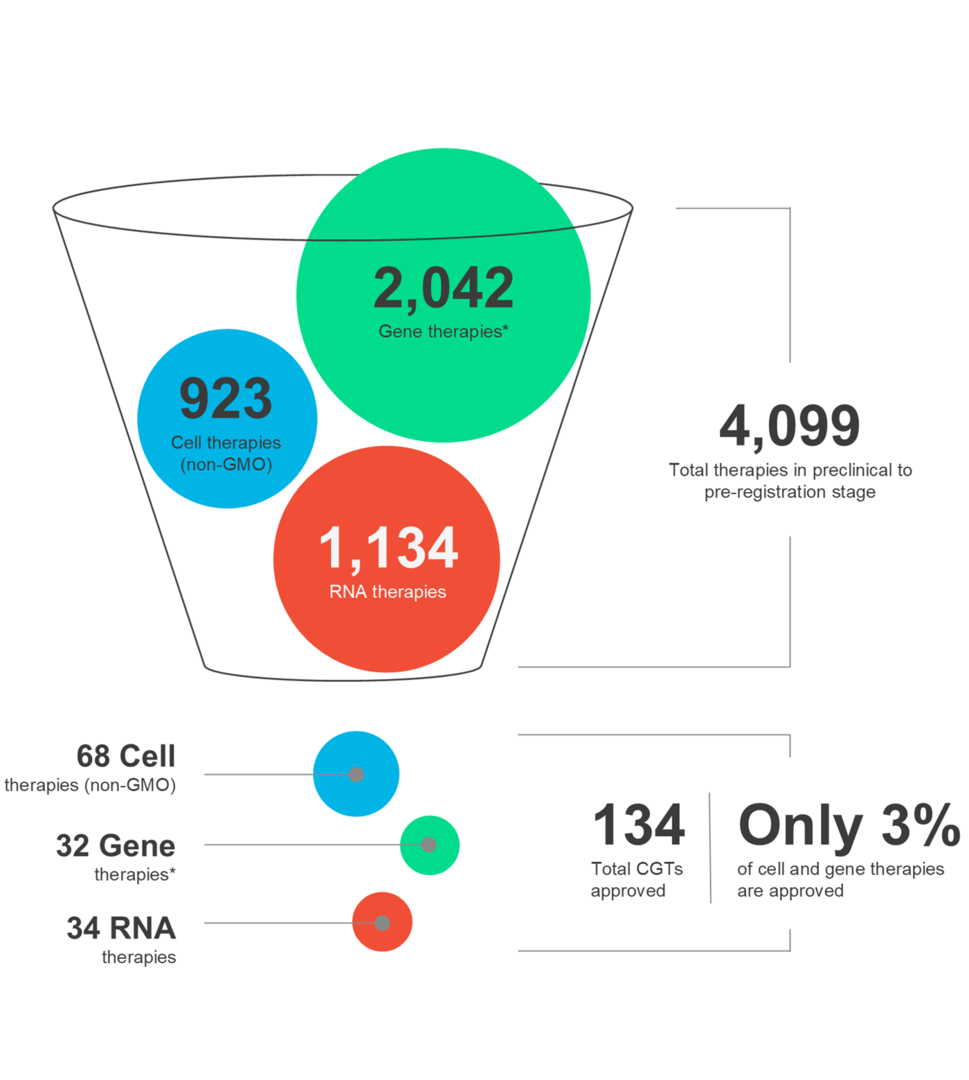
Zell- und Gentherapien (CGTs) prägen die Zukunft der Medizin und geben Patienten weltweit neue Hoffnung. Diese neuartigen Therapien haben die Fähigkeit, auf eine Vielzahl von Erkrankungen abzuzielen. Es ist jedoch wichtig zu erkennen, dass die CGT-Landschaft dynamisch ist und der therapeutische Erfolg eine sorgfältige Berücksichtigung mehrerer Faktoren während des gesamten Arzneimittelentwicklungs- und -vertriebsprozesses erfordert.
In unserer neuesten Infografik erfahren Sie mehr über die neuesten Markttrends und die Nuancen der verschiedenen CGT-Modalitäten sowie über autologe und allogene Therapien.

FAQs zur Entwicklungspipeline für Zelltherapien
Welche Zelltherapien sind zugelassen?
Es gibt viele zugelassene Zelltherapien, einige Beispiele sind:
- Kymirah (tisagenlecleucel): Eine Art der Immuntherapie, die als CAR-T-Zelltherapie bekannt ist und zur Behandlung bestimmter Arten von Non-Hodgkin-Lymphomen und akuter lymphatischer Leukämie eingesetzt wird
- Yescarta (axicabtagene ciloleucel): Eine CAR-T-Zelltherapie zur Behandlung von großzelligen B-Zell-Lymphomen nach zwei oder mehr systemischen Therapielinien
- Provenge (sipuleucel-T): Autologe zelluläre Immuntherapie, die zur Behandlung von asymptomatischem oder minimal symptomatischem metastasiertem kastrationsresistentem Prostatakrebs indiziert ist
Wie läuft das Genehmigungsverfahren für eine Zelltherapie ab?
Die Zulassung von Zelltherapien ist ein strenger Prozess, der von Aufsichtsbehörden wie der Food and Drug Administration (FDA) überwacht wird. Es beginnt mit präklinischen Tests in Laboren und Tiermodellen, gefolgt von einem IND-Antrag (Investigational New Drug). Im Falle einer Genehmigung werden klinische Studien in drei Phasen durchgeführt, um Sicherheit, Wirksamkeit und Dosierung zu bewerten. Nach der Studie wird ein Zulassungsantrag für Biologika (Biologics License Application, BLA) zur Prüfung eingereicht. Im Erfolgsfall wird die Therapie für den Markt zugelassen, aber weiterhin auf Langzeitfolgen überwacht.
Wie viele zugelassene Zelltherapien gibt es?
Die Anzahl der zugelassenen Zelltherapien kann von Land zu Land variieren, da jedes Land seine eigenen Aufsichtsbehörden und Zulassungsverfahren hat. In den USA werden Zelltherapien von der FDA reguliert, während sie in Europa in den Zuständigkeitsbereich der Europäischen Arzneimittel-Agentur fallen. Diese Agenturen haben unterschiedliche Kriterien und Fristen für die Genehmigung. Darüber hinaus werden mit den Fortschritten in der medizinischen Forschung und Technologie ständig neue Zelltherapien entwickelt und getestet. Folglich wächst die Zahl der zugelassenen Zelltherapien weltweit stetig.




