4 Fragen an Ben Penley

Erörterung des Informationsbedarfs der Zahler vor der Zulassung und wie Hersteller diesen besser erfüllen können


Was hat Sie zu dieser Forschung inspiriert?
Im Dezember 2022 wurde das Gesetz über den Informationsaustausch vor der Genehmigung (PIE) verabschiedet. Vieles von dem, was in den endgültigen Leitlinien der Food and Drug Administration (FDA) zur Kommunikation zwischen Kostenträgern und Herstellern vor der Zulassung festgelegt wurde, wurde in ein Gesetz umgesetzt und schuf einen dauerhaften sicheren Hafen für Hersteller, um sich proaktiv an PIE zu beteiligen.
Wir wollten wissen, ob es nach der Verabschiedung des PIE-Gesetzes immer noch eine Lücke zwischen den Informationen gibt, die die Kostenträger vor der Zulassung von den Herstellern erhalten, im Vergleich zu dem, was sie benötigen, um Entscheidungen über die Rezeptur zu treffen. Wir wollten auch verstehen, bei welcher Art von Informationen die Lücke am weitesten verbreitet war, wenn diese Lücke existierte?
Was sind die wichtigsten Erkenntnisse aus Ihrer Forschung?
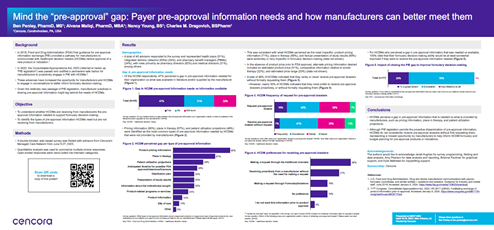
Unsere Umfrage wurde im Juni 2023 durchgeführt. Von den 45 Befragten repräsentierten 51 % Krankenversicherungen, 24 % integrierte Liefernetzwerke und 24 % Pharmacy Benefit Manager. Ihre Rollen innerhalb dieser Organisationen waren aufgeteilt in Apothekendirektoren (62 %) und medizinische Direktoren (31 %) als die beiden führenden Rollen. In geografischer Hinsicht gab es eine fast gleichmäßige Aufteilung zwischen nationalen und regionalen Plänen.
Unsere erste Erkenntnis war, dass die Lücke immer noch besteht: Etwa 50 Prozent der Kostenträger gaben an, dass es eine Lücke zwischen den Informationen vor der Zulassung gab, die sie benötigten, um Entscheidungen über die Rezeptur zu treffen, im Vergleich zu denen, die ihnen entweder vom Hersteller zur Verfügung gestellt wurden oder öffentlich zugänglich waren.
Die wichtigsten Arten von Informationen, bei denen diese Lücke auftrat, waren Informationen zu Produktpreisen (90 %), Prognosen zur Patientenauslastung (48 %) und der voraussichtliche Zeitplan für die FDA-Zulassung (38 %). Das Verständnis der Kosten, der voraussichtlichen Nutzung und des Zeitpunkts, zu dem die Therapie verfügbar sein würde, waren also die wichtigsten Arten von Informationen vor der Zulassung, die die Kostenträger benötigten, aber nicht erhalten hatten.
Eine weitere wichtige Erkenntnis bezog sich auf die Auswirkungen des Schließens der Lücke. Wäre ihre Entscheidungsfindung verbessert, wenn die Kostenträger die Informationen vor der Genehmigung hätten, die sie benötigen? Kurz gesagt, wir stellten fest, dass alle Befragten angaben, dass ihre Entscheidungsfindung verbessert werden würde.
Gab es irgendetwas in der Forschung, das Sie überrascht hat, das Sie nicht erwartet haben, das Sie herausgefunden haben?
Wir waren überrascht, dass 50 % der Kostenträger immer noch eine Lücke sahen, obwohl der PIE Act seit fast 18 Monaten in Kraft ist. Darüber hinaus gaben nur 7 % der Kostenträger an, dass sie häufig proaktiv Dossiers vor der Zulassung erhielten. Wir sind der Meinung, dass Hersteller sich befähigt fühlen sollten, Informationen proaktiv mit den Kostenträgern zu teilen, damit diese fundiertere Entscheidungen treffen können.
Was sind die nächsten Schritte dieser Forschung?
Unsere nächste Umfrage zu diesem Thema wird sich mehr mit den Ergebnissen von PIE befassen. Wir wissen, dass die Kostenträger diese Informationen wollen – wir wissen, dass die Zahler diese Informationen brauchen. Wir wollen uns nun ansehen, was diese Ergebnisse für Hersteller sind, die sich erfolgreich mit PIE beschäftigen.
Wir stellten fest, dass alle Kostenträger der Meinung waren, dass die Schließung der PIE-Lücke ihre Entscheidungsfindung bei der Herstellung von Arzneimitteln verbessern würde. Aber wir wollen verstehen, wie genau es verbessert werden könnte. Würde es die Kostenträger nur besser informieren? Wären die Kostenträger in der Lage, schneller Entscheidungen zu treffen? Welche Auswirkungen hätte es auf die Art und Weise, wie ein Produkt bewertet wird? Das ist etwas, das wir in zukünftigen Forschungen untersuchen wollen.
Zitate, die für den hier beschriebenen Inhalt relevant sind, finden Sie in dem hier verlinkten Artikel. Die Leser sollten alle verfügbaren Informationen zu den hier genannten Themen überprüfen und sich bei der Entscheidungsfindung auf ihre eigenen Erfahrungen und ihr Fachwissen verlassen.
Wir sind Cencora. Unsere gemeinsame Identität verbindet uns.




