4 questions à Ben Penley

Discuter des besoins en information préalable à l’approbation des payeurs et de la façon dont les fabricants peuvent mieux y répondre


Qu’est-ce qui a inspiré cette recherche ?
La Loi sur l’échange d’informations préalables à l’approbation (PIE) a été adoptée en décembre 2022. Il a repris une grande partie de ce qui était spécifié dans les directives finales de la Food and Drug Administration (FDA) sur les communications préalables à l’approbation entre les payeurs et les fabricants et l’a transformé en loi, créant ainsi une sphère de sécurité permanente permettant aux fabricants de s’engager de manière proactive dans le PIE.
Nous voulions comprendre, avec l’adoption de la Loi sur les EPI, s’il y avait encore un écart entre les renseignements préalables à l’approbation que les payeurs recevaient des fabricants et ce dont ils avaient besoin pour prendre des décisions en matière de formulaires. Nous voulions également comprendre si cet écart existait, pour quels types d’information était-il le plus répandu ?
Quels sont les principaux points à retenir de vos recherches ?
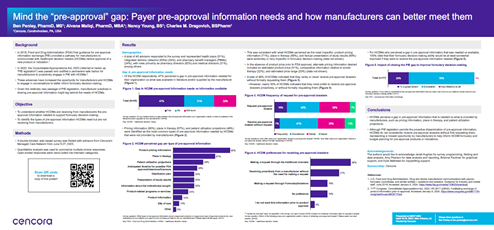
Notre enquête a été menée en juin 2023. Sur les 45 répondants, 51 % représentaient des régimes de soins de santé, 24 % des réseaux de prestation intégrés et 24 % des gestionnaires de prestations pharmaceutiques. Leurs rôles au sein de ces organisations étaient répartis entre les directeurs de pharmacie (62 %) et les directeurs médicaux (31 %). Sur le plan géographique, il y a eu une répartition presque égale entre les plans nationaux et régionaux.
La première chose que nous avons retenue, c’est qu’il existe toujours une lacune : environ 50 % des payeurs ont indiqué qu’il y avait une lacune entre les renseignements préalables à l’approbation dont ils avaient besoin pour prendre des décisions concernant les formulaires et ce qui était à leur disposition, qu’ils soient fournis par le fabricant ou accessibles au public.
Les principaux types d’information pour lesquels cette lacune était présente étaient les informations sur les prix des produits (90 %), les projections d’utilisation par les patients (48 %) et le calendrier prévu pour l’approbation de la FDA (38 %). Ainsi, la compréhension du coût, de l’utilisation prévue et du moment où le traitement serait disponible étaient les principaux types d’informations préalables à l’approbation dont les payeurs avaient besoin, mais qu’ils n’avaient pas reçues.
Une autre constatation importante concernait l’incidence de la réduction de l’écart. Si les payeurs disposaient de l’information préalable à l’approbation dont ils ont besoin, leur prise de décision serait-elle améliorée ? En bref, nous avons constaté que oui, tous les répondants ont déclaré que leur prise de décision serait améliorée.
Y a-t-il quelque chose dans la recherche qui était surprenant, auquel vous ne vous attendiez pas, que vous avez découvert ?
Nous avons été surpris de constater que 50 % des payeurs perçoivent encore un écart, même si la Loi sur l’EPI est en vigueur depuis près de 18 mois. De plus, seulement 7 % des payeurs ont déclaré qu’ils recevaient fréquemment des dossiers de préapprobation de manière proactive. Nous pensons que les fabricants devraient se sentir habilités à partager l’information de manière proactive avec les payeurs afin qu’ils puissent prendre des décisions plus éclairées.
Quelles sont les prochaines étapes de cette recherche ?
Notre prochaine enquête sur ce sujet se penchera davantage sur les résultats de l’EPI. Nous savons que les payeurs veulent cette information, nous savons qu’ils ont besoin de cette information. Nous voulons maintenant examiner quels sont ces résultats pour les fabricants qui s’engagent avec succès dans l’EPI.
Nous avons constaté que tous les payeurs pensaient que combler l’écart en matière d’EPI améliorerait leur prise de décision en ce qui concerne les formulaires. Mais nous voulons comprendre exactement comment cela pourrait être amélioré. Est-ce que cela ne ferait que rendre les payeurs plus informés ? Les payeurs seraient-ils en mesure de prendre des décisions plus rapidement ? Quel impact cela aurait-il sur la façon dont un produit est évalué ? C'est quelque chose que nous prévoyons d'examiner dans de futures recherches.
Les citations pertinentes pour le contenu décrit ici sont fournies dans l’article lié ici. Les lecteurs sont invités à examiner toutes les informations disponibles sur les sujets mentionnés dans le présent document et à se fier à leur propre expérience et à leur expertise pour prendre des décisions à ce sujet.




