Nye muligheter for legemidler i Europa? Hvordan JCA og Project Orbis kan påvirke inntektspotensialet til innovative legemidler
JCA og Project Orbis: Akselerere pasienttilgangen til onkologiske behandlinger i hele Europa


Mens omfattende forskning har utforsket deres innvirkning på viktige bransjefaktorer – som tid til marked (TTM) og tilgjengelighet av medisiner – har deres økonomiske implikasjoner, spesielt deres innvirkning på medisininntekter, fått relativt mindre oppmerksomhet. Å forstå disse kommersielle effektene er avgjørende, ettersom fremskyndede godkjenninger og bredere tilgang kan låse opp nye inntektsmuligheter samtidig som det introduserer prisutfordringer på grunn av internasjonal referanseprising (IRP) praksis som vanligvis brukes over hele Europa.

Oversikt over JCA og Project Orbis
JCA er designet for å evaluere effektiviteten og sikkerheten til nye produkter gjennom en samarbeidende, harmonisert tilnærming på tvers av EUs medlemsland. Siden januar 2025 er JCA obligatorisk for alle onkologiske og avanserte terapilegemidler (ATMP). Det europeiske legemiddelbyråets (EMA) foreldreløse produkter vil bli inkludert innen 2028, etterfulgt av alle EMA-registrerte produkter innen 2030. Dette initiativet har direkte innvirkning på alle EU27-medlemslandene, Norge og Island.
Prosjekt Orbis
Project Orbis legger til rette for samtidig innsending og gjennomgang av onkologiprodukter blant internasjonale regulatoriske partnere. Ledet av United States Food and Drug Administration (FDA), er hovedmålet å akselerere pasienttilgangen til innovative kreftbehandlinger som gir kliniske fordeler i forhold til eksisterende terapier. Deltakende europeiske tilsynsmyndigheter inkluderer Storbritannias reguleringsbyrå for legemidler og helseprodukter (MHRA) og Sveits (Swissmedic).

Kvantifisering av inntektseffekten
Vår tilnærming sammenlignet inntektsprognoser under et pre-JCA- og Project Orbis-scenario – som representerer tradisjonelle regulatoriske og refusjonsveier – med 5 alternative lanseringsscenarier. Hvert scenario inkorporerte forskjellige forutsetninger om hvordan JCA og Project Orbis påvirker TTM i hvert land og inntektsgenerering.
Pre-JCA og Project Orbis-scenario
Inntektspotensialet før introduksjonen av JCA og Project Orbis ble estimert basert på 48 onkologiprodukter godkjent i Europa mellom 2019 og 2022 som ikke deltok i Project Orbis. TTM ble definert som antall dager mellom markedsføringstillatelse og pasientens tilgjengelighet i hvert land. Inntektsprognoser over en 5-årsperiode vurderte listepriser, markedsstørrelse og IRP-regler:
- TTM var basert på EFPIA WAIT-rapporten
- Listepriser for hvert land ble fastsatt basert på median årlig behandlingskostnad for onkologiproduktene. På grunn av kompleksiteten i prisdynamikken og virkningen av ikke-transparente rabatter, er denne analysen avhengig av listepriser i stedet for nettopriser for å sikre konsistens i evalueringen.
- Europeiske markedsstørrelsesestimater, tatt i betraktning befolkningen og onkologiutgifter per innbygger.
- IRP-applikasjoner ved lansering og etter lansering, etter data fra Navlin IRP-matrisen.
JCA og Project Orbis-scenario
For å evaluere virkningen av varierende akselerasjonshastigheter, gjennomførte vi en sensitivitetsanalyse, og vurderte inntektsimplikasjoner for TTM-akselerasjon fra 10 % til 40 %.
Under Project Orbis anslår vi at Sveits kan oppleve TTM-akselerasjoner på opptil 7 måneder – en antagelse basert på innsendingsgapet og gjennomgangstidene for onkologiprodukter under Project Orbis vs ikke-Project Orbis-veier i Sveits. Vi forventer imidlertid ingen endringer for Storbritannia siden det er uklart om den britiske regulatoriske tidslinjen virkelig er fremskyndet med Project Orbis. (Se Tabell 1).
Tabell 1. Sammendrag av TTM-scenario
Scenario |
TTM |
|
Pre-JCA og Project Orbis |
Medianen for TTM for de 48 onkologiproduktene som ble lansert i Europa mellom 2019 og 2022 |
|
Scenario 1 |
STORBRITANNIA: Ingen endring i TTM CH: 7 måneders akselerert TTM BE, NE, DK, ES: 10 % akselerert TTM + 100 dager Andre land: 10 % akselerert TTM |
|
Scenario 2 |
STORBRITANNIA: Ingen endring i TTM CH: 7 måneders akselerert TTM BE, NE, DK, ES: 20 % akselerert TTM + 100 dager Andre land: 20 % akselerert TTM |
|
Scenario 3 (Grunnscenario) |
STORBRITANNIA: Ingen endring i TTM CH: 7 måneders akselerert TTM BE, NE, DK, ES: 25 % akselerert TTM-scenario + 100 dager Andre land: 25 % akselerert TTM |
|
Scenario 4 |
STORBRITANNIA: Ingen endring i TTM CH: 7 måneders akselerert TTM BE, NE, DK, ES: 30 % akselerert TTM + 100 dager Andre land: 30 % akselerert TTM |
|
Scenario 5 |
STORBRITANNIA: Ingen endring i TTM CH: 7 måneders akselerert TTM BE, NE, DK, ES: 40 % akselerert TTM + 100 dager Andre land: 40 % akselerert TTM |
Nøkkel: VÆRE: Belgia; CH: Sveits; DK: Danmark; ES: Spania; JCA: felles klinisk vurdering; NE: Nederland; TTM: tid til markedet; STORBRITANNIA: Storbritannia.
Beregninger av inntekter
Ved hjelp av vår interne inntektskalkulator gjennomførte vi en omfattende 5-årig inntektsprognose for hvert scenario og sammenlignet resultatene med scenariet før JCA og Project Orbis.
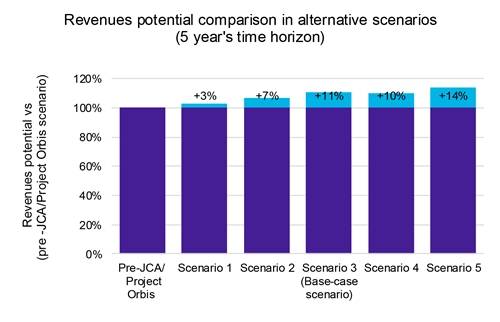
Vår analyse indikerer at selv om akselererte produktlanseringer fører til beskjeden, men merkbar priserosjon (figur 1), oppveier fordelene ulempene. Raskere markedsinngang gjør det mulig å ta en større markedsandel på kortere tid, noe som til syvende og sist øker den samlede lønnsomheten (figur 2).
Videre avslørte vår inntektssensitivitetsanalyse på tvers av disse scenariene en potensiell inntektsøkning på 14 %, noe som understreker de potensielle økonomiske fordelene ved en fremskyndet lanseringsstrategi.

Nøkkel: IRP: internasjonal referanseprising; JCA: Felles klinisk vurdering.
Nøkkel: JCA: Felles klinisk vurdering.
Konklusjoner
Selv om raskere priserosjon fortsatt er en vurdering, oppveier det økte salgsvolumet denne risikoen over en 5-årsperiode. Som et resultat vil produsenter som tar i bruk fremskyndede lanseringsstrategier under JCA og Project Orbis få økonomiske fordeler samtidig som de sikrer bredere tilgang til livreddende terapier.
Begrensninger i våre analyser
Analysen har flere viktige begrensninger:
- Beregning av inntekter: Inntektene er estimert ved hjelp av listepriser i stedet for nettopriser, da nettopriser på legemidler er sterkt påvirket av konfidensielle avtaler og hemmelige rabatter. For å sikre konsistens vurderes potensielle inntekter basert på offentlig tilgjengelige listepriser.
- Grunnleggende TTM: Den estimerte TTM for Storbritannia og Sveits før JCA og Project Orbis kan avvike noe fra denne analysens forutsetninger. Denne variasjonen oppstår fordi ni av de 48 produktene som ble brukt til å vurdere landspesifikk TTM ble evaluert gjennom Project Orbis.
- IRP-vurderinger: Både formelle og uformelle IRP-regler er tatt i betraktning. Imidlertid er uformelle IRP-regler utfordrende å evaluere på grunn av inkonsekvent implementering. Det ble gjort forutsetninger for å anslå i hvilken grad denne uformelle prispolitikken anvendes.
Denne artikkelen oppsummerer Cencoras forståelse av emnet basert på offentlig tilgjengelig informasjon i skrivende stund (se oppførte kilder) og forfatternes ekspertise på dette området. Eventuelle anbefalinger gitt i artikkelen gjelder kanskje ikke for alle situasjoner og utgjør ikke juridisk rådgivning; Lesere bør ikke stole på artikkelen når de tar avgjørelser knyttet til temaene som diskuteres.
Ta kontakt med teamet vårt

Kilder
- Den europeiske føderasjonen for farmasøytiske produkter (EFPI). Pasienter W.A.I.T.-indikator 2023-undersøkelse. juni 2024. https://efpia.eu/media/vtapbere/efpia-patient-wait-indicator-2024.pdf
- Den europeiske union. felles klinisk vurdering for legemidler. januar 2025. https://health.ec.europa.eu/document/download/ced91156-ffe1-472d-85eb-aa6a91dd707e_en?filename=hta_htar_factsheet-jca_en.pdf
- Storbritannias regjering. Veiledning om Project Orbis. Sist oppdatert 10 januar 2025. https://www.gov.uk/guidance/guidance-on-project-orbis
- Det europeiske legemiddelkontoret (The European Medicines Agency). Nasjonale kompetente myndigheter (menneskelige). https://www.ema.europa.eu/en/partners-networks/eu-partners/eu-member-states/national-competent-authorities-human
- Verdensbanken. Befolkning totalt. Sist oppdatert 16 desember 2024. https://data.worldbank.org/indicator/SP.POP.TOTL
- Kostnader for behandling. 31. desember 2024. Hentet fra Navlin-databasen.
- Internasjonale regler for referansepriser. 31. desember 2024. Hentet fra Navlin-databasen.
- Vrdoljak E, Bodoky G, Jassem J, et al. Utgifter til onkologiske legemidler og forholdet mellom dødelighet og forekomst av kreft i Sentral- og Øst-Europa. Onkolog. 2019; 24(1):e30-e37. doi:10.1634/theoncologist.2018-0093. https://pmc.ncbi.nlm.nih.gov/articles/PMC6324644/
- Sveitsermedisiner. Prosjekt Orbis: raskere tilgang til lovende kreftbehandlinger. 29. mai 2024. https://www.swissmedic.ch/swissmedic/en/home/news/mitteilungen/project-orbis-schnellerer-zugang-krebsbehandlungen.html
- Presisjonsrådgivere. Tilgangslandskapet etter Brexit i Storbritannia: akselererer Project Orbis pasienttilgangen for onkologiske legemidler betydelig i Storbritannia kontra Europa? 2023. https://www.ispor.org/docs/default-source/intl2023/ispor23kennedyposter-project-orbis-pdf.pdf?sfvrsn=edc15b3_0



