Onderzoek naar de logistiek en modaliteiten van cel- en gentherapie
Bijgewerkt voor 2024 Q3

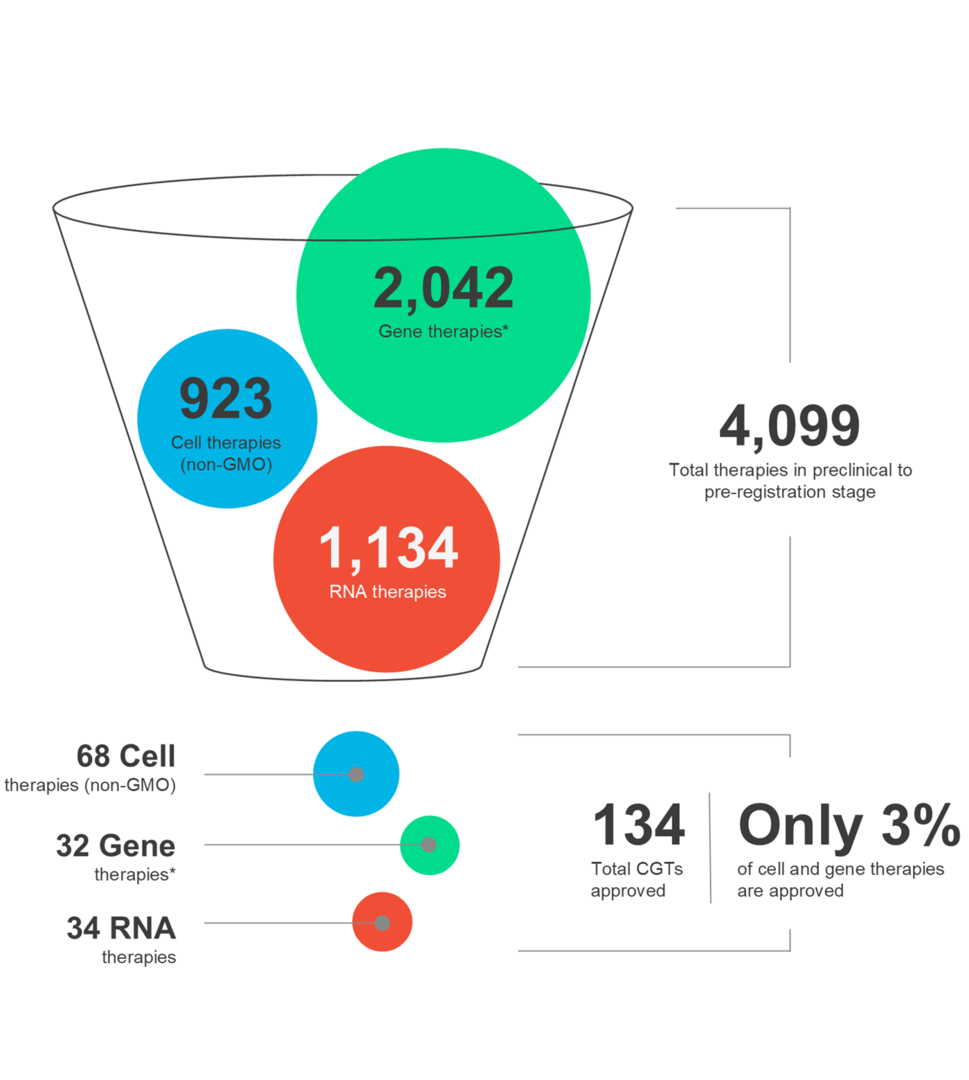
Cel- en gentherapieën (CGT's) geven vorm aan de toekomst van de geneeskunde en bieden patiënten over de hele wereld nieuwe hoop. Deze geavanceerde therapieën hebben de kracht om een breed scala aan aandoeningen aan te pakken. Het is echter cruciaal om te erkennen dat het CGT-landschap dynamisch is en dat therapeutisch succes een zorgvuldige afweging van meerdere factoren vereist tijdens het hele ontwikkelings- en distributieproces van geneesmiddelen.
Ontdek in onze nieuwste infographic de nieuwste markttrends en de nuances van verschillende CGT-modaliteiten, samen met autologe en allogene therapieën.

Veelgestelde vragen over de pijplijn voor de ontwikkeling van celtherapie
Welke celtherapieën zijn goedgekeurd?
Er zijn veel goedgekeurde celtherapieën, enkele voorbeelden zijn:
- Kymirah (tisagenlecleucel): Een type immunotherapie dat bekend staat als CAR-T-celtherapie en wordt gebruikt voor de behandeling van bepaalde soorten non-Hodgkin-lymfoom en acute lymfatische leukemie
- Yescarta (axicabtagene ciloleucel): Een CAR-T-celtherapie die wordt gebruikt voor de behandeling van grootcellige B-cellymfomen na twee of meer lijnen systemische therapie
- Provenge (sipuleucel-T): Een autologe cellulaire immunotherapie geïndiceerd voor de behandeling van asymptomatische of minimaal symptomatische gemetastaseerde castratieresistente prostaatkanker
Wat is het goedkeuringsproces voor celtherapie?
Goedkeuring van celtherapie omvat een rigoureus proces onder toezicht van regelgevende instanties zoals de Food and Drug Administration (FDA). Het begint met preklinische tests in laboratoria en diermodellen, gevolgd door een aanvraag voor een nieuw geneesmiddel (IND). Indien goedgekeurd, worden klinische onderzoeken in drie fasen uitgevoerd om de veiligheid, werkzaamheid en dosering te beoordelen. Na het proces wordt een Biologics License Application (BLA) ter beoordeling ingediend. Als de therapie succesvol is, wordt deze goedgekeurd voor de markt, maar wordt deze nog steeds gecontroleerd op langetermijneffecten.
Hoeveel goedgekeurde celtherapieën zijn er?
Het aantal goedgekeurde celtherapieën kan per land verschillen, omdat elk zijn eigen regelgevende instanties en goedkeuringsprocessen heeft. In de VS worden celtherapieën gereguleerd door de FDA, terwijl ze in Europa onder de bevoegdheid van het Europees Geneesmiddelenbureau vallen. Deze bureaus hebben verschillende criteria en tijdlijnen voor goedkeuring. Bovendien worden met de vooruitgang in medisch onderzoek en technologie voortdurend nieuwe celtherapieën ontwikkeld en getest. Bijgevolg groeit het aantal goedgekeurde celtherapieën wereldwijd gestaag.




