De nouvelles opportunités pour les médicaments en Europe ? L’impact de la JCA et du projet Orbis sur le potentiel de revenus des médicaments innovants
JCA et le projet Orbis : Accélérer l’accès des patients aux traitements oncologiques en Europe


Bien que des recherches approfondies aient exploré leur incidence sur les facteurs clés de l’industrie, tels que le temps de mise sur le marché et la disponibilité des médicaments, leurs répercussions financières, en particulier leur incidence sur les revenus des médicaments, ont reçu comparativement moins d’attention. Il est essentiel de comprendre ces effets commerciaux, car les approbations accélérées et un accès plus large peuvent débloquer de nouvelles opportunités de revenus tout en introduisant des défis de tarification en raison des pratiques de tarification de référence internationales (IRP) couramment appliquées en Europe.

Aperçu de la JCA et du projet Orbis
La JCA est conçue pour évaluer l’efficacité et l’innocuité des nouveaux produits grâce à une approche collaborative et harmonisée entre les États membres de l’Union européenne (UE). Depuis janvier 2025, la JCA est obligatoire pour tous les médicaments oncologiques et de thérapie innovante (ATMP). Les produits orphelins de l’Agence européenne des médicaments (EMA) seront inclus d’ici 2028, suivis de tous les produits enregistrés par l’EMA d’ici 2030. Cette initiative a un impact direct sur tous les États membres de l’UE27, la Norvège et l’Islande.
Projet Orbis
Le projet Orbis facilite la soumission et l’examen simultanés de produits oncologiques entre les partenaires internationaux en matière de réglementation. Dirigée par la Food and Drug Administration (FDA) des États-Unis, son objectif principal est d’accélérer l’accès des patients à des traitements innovants contre le cancer qui offrent des avantages cliniques par rapport aux thérapies existantes. Les autorités réglementaires européennes participantes comprennent l’Agence de réglementation des médicaments et des produits de santé du Royaume-Uni (MHRA) et la Suisse (Swissmedic).

Quantifier l’incidence sur les revenus
Notre approche a comparé les projections de revenus dans un scénario pré-JCA et le projet Orbis, représentant les voies réglementaires et de remboursement traditionnelles, avec 5 scénarios de lancement alternatifs. Chaque scénario comprenait des hypothèses différentes concernant la façon dont JCA et le projet Orbis influencent la gestion du territoire dans chaque pays et la génération de revenus.
Scénario antérieur à la JCA et au projet Orbis
Le potentiel de revenus avant l’introduction de la JCA et du projet Orbis était estimé sur la base de 48 produits oncologiques approuvés en Europe entre 2019 et 2022 qui n’ont pas participé au projet Orbis. La MTT a été définie comme le nombre de jours entre l’autorisation de mise en marché et la disponibilité des patients dans chaque pays. Les projections de revenus sur une période de 5 ans ont tenu compte des prix courants, de la taille du marché et des règles du PRI :
- Le TTM était basé sur le rapport WAIT de l’EFPIA
- Les prix courants pour chaque pays ont été déterminés en fonction du coût annuel médian du traitement des produits oncologiques. En raison de la complexité de la dynamique des prix et de l’incidence des rabais non transparents, cette analyse repose sur les prix courants plutôt que sur les prix nets pour assurer l’uniformité de l’évaluation.
- Estimations de la taille du marché européen, en tenant compte de la population et des dépenses oncologiques par habitant.
- Demandes IRP au lancement et après le lancement, à la suite des données de la matrice IRP de Navlin.
Scénario de la JCA et du projet Orbis
Pour évaluer l’impact des différents taux d’accélération, nous avons effectué une analyse de sensibilité, évaluant les répercussions sur les revenus de l’accélération du TTM allant de 10 % à 40 %.
Dans le cadre du projet Orbis, nous estimons que la Suisse pourrait connaître des accélérations du TTM allant jusqu’à 7 mois, une hypothèse basée sur l’écart entre les soumissions et les délais d’examen des produits oncologiques dans le cadre du projet Orbis et des voies non liées au projet Orbis en Suisse. Cependant, nous ne prévoyons aucun changement pour le Royaume-Uni, car il n’est pas clair si l’échéancier réglementaire du Royaume-Uni est vraiment accéléré avec le projet Orbis. (voir Tableau 1).
Tableau 1. Résumé du scénario TTM
Scénario |
TTM |
|
Avant la JCA et le projet Orbis |
Médiane du TTM des 48 produits oncologiques lancés en Europe entre 2019 et 2022 |
|
Scénario 1 |
Royaume-Uni : Aucun changement dans le TTM CH : 7 mois TTM accéléré BE, NE, DK, ES : 10 % TTM accéléré + 100 jours Autres pays : 10 % TTM accéléré |
|
Scénario 2 |
Royaume-Uni : Aucun changement dans le TTM CH : 7 mois TTM accéléré BE, NE, DK, ES : 20 % TTM accéléré + 100 jours Autres pays : 20 % TTM accéléré |
|
Scénario 3 (Scénario de référence) |
Royaume-Uni : Aucun changement dans le TTM CH : 7 mois TTM accéléré BE, NE, DK, ES : Scénario de MTT accéléré de 25 % + 100 jours Autres pays : 25 % TTM accéléré |
|
Scénario 4 |
Royaume-Uni : Aucun changement dans le TTM CH : 7 mois TTM accéléré BE, NE, DK, ES : 30 % TTM accéléré + 100 jours Autres pays : 30 % TTM accéléré |
|
Scénario 5 |
Royaume-Uni : Aucun changement dans le TTM CH : 7 mois TTM accéléré BE, NE, DK, ES : 40 % TTM accéléré + 100 jours Autres pays : 40 % TTM accéléré |
Légende : BE : Belgique; CH : Suisse; DK : Danemark; ES : Espagne; JCA : évaluation clinique conjointe ; NE : Pays-Bas ; TTM : délai de mise sur le marché ; Royaume-Uni : Royaume-Uni.
Calcul des revenus
À l’aide de notre calculateur de revenus internes, nous avons effectué une projection complète des revenus sur 5 ans pour chaque scénario et comparé les résultats au scénario antérieur à la JCA et au projet Orbis.
Notre analyse indique que si les lancements de produits accélérés entraînent une érosion des prix modeste mais notable (graphique 1), les avantages l’emportent sur les inconvénients. Une entrée plus rapide sur le marché permet de conquérir une plus grande part de marché dans un délai plus court, ce qui augmente la rentabilité globale (graphique 2).
De plus, notre analyse de la sensibilité des revenus dans ces scénarios a révélé une augmentation potentielle de 14 % des revenus, soulignant les avantages financiers potentiels d’une stratégie de lancement accéléré.

Légende : IRP : prix de référence international ; JCA : Évaluation clinique conjointe.
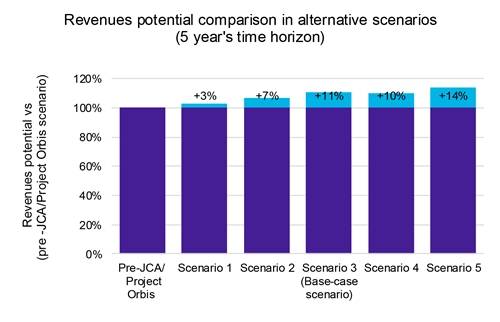
Légende : JCA : Évaluation clinique conjointe.
En conclusion
Bien qu’une érosion plus rapide des prix demeure à considérer, l’augmentation du volume des ventes compense ce risque sur une période de 5 ans. Par conséquent, les fabricants qui adoptent des stratégies de lancement accéléré dans le cadre de la JCA et du projet Orbis pourraient obtenir des avantages financiers tout en garantissant un accès plus large aux thérapies qui sauvent des vies.
Limites de nos analyses
L’analyse comporte plusieurs limites importantes :
- Calcul des revenus : Les revenus sont estimés à l’aide des prix courants plutôt que des prix nets, car les prix nets des produits pharmaceutiques sont fortement influencés par les ententes confidentielles et les rabais non divulgués. Par souci d’uniformité, les revenus potentiels sont évalués en fonction des prix courants accessibles au public.
- TTM de base : La MTT estimée pour le Royaume-Uni et la Suisse avant la JCA et le projet Orbis peut différer légèrement des hypothèses de la présente analyse. Cet écart est dû au fait que neuf des 48 produits utilisés pour évaluer le TTM propre à chaque pays ont été évalués dans le cadre du projet Orbis.
- Considérations relatives au PRI : Les règles formelles et informelles du PRI ont été prises en compte. Cependant, les règles informelles du PRI sont difficiles à évaluer en raison de leur mise en œuvre incohérente. Des hypothèses ont été formulées pour estimer la mesure dans laquelle ces politiques informelles de tarification sont appliquées.
Cet article résume la compréhension du sujet par Cencora sur la base d’informations accessibles au public au moment de la rédaction (voir les sources énumérées) et de l’expertise des auteurs dans ce domaine. Les recommandations formulées dans l’article peuvent ne pas s’appliquer à toutes les situations et ne constituent pas des conseils juridiques. Les lecteurs ne doivent pas se fier à l’article pour prendre des décisions liées aux sujets abordés.
Entrez en contact avec notre équipe

Bibliographie
- Fédération européenne des produits pharmaceutiques (EFPI). Enquête sur l’indicateur W.A.I.T. 2023 des patients. Juin 2024. https://efpia.eu/media/vtapbere/efpia-patient-wait-indicator-2024.pdf
- Union européenne. Évaluation clinique conjointe des produits médicinaux. Janvier 2025. https://health.ec.europa.eu/document/download/ced91156-ffe1-472d-85eb-aa6a91dd707e_en?filename=hta_htar_factsheet-jca_en.pdf
- Gouvernement du Royaume-Uni. Lignes directrices sur le projet Orbis. Dernière mise à jour le 10 janvier 2025. https://www.gov.uk/guidance/guidance-on-project-orbis
- Agence européenne des médicaments. Autorités nationales compétentes (humaines). https://www.ema.europa.eu/en/partners-networks/eu-partners/eu-member-states/national-competent-authorities-human
- Banque mondiale. Population totale. Dernière mise à jour le 16 décembre 2024. https://data.worldbank.org/indicator/SP.POP.TOTL
- Coût du traitement. 31 décembre 2024. Extrait de la base de données Navlin.
- Règles internationales de tarification de référence. 31 décembre 2024. Extrait de la base de données Navlin.
- Vrdoljak E, Bodoky G, Jassem J, et al. Dépenses en médicaments oncologiques et ratio mortalité-incidence par cancer en Europe centrale et orientale. Oncologue. 2019; 24(1) :E30-E37. doi : 10.1634/theoncologist.2018-0093. https://pmc.ncbi.nlm.nih.gov/articles/PMC6324644/
- Swissmedic. Projet Orbis : accès plus rapide à des traitements prometteurs contre le cancer. 29 mai 2024. https://www.swissmedic.ch/swissmedic/en/home/news/mitteilungen/project-orbis-schnellerer-zugang-krebsbehandlungen.html
- Conseillers de précision. Le paysage de l’accès au Royaume-Uni après le Brexit : le projet Orbis accélère-t-il considérablement l’accès des patients aux médicaments oncologiques au Royaume-Uni par rapport à l’Europe ? 2023. https://www.ispor.org/docs/default-source/intl2023/ispor23kennedyposter-project-orbis-pdf.pdf?sfvrsn=edc15b3_0



