Exploration de la logistique et des modalités de thérapie cellulaire et génique
Mise à jour pour le T3 2024

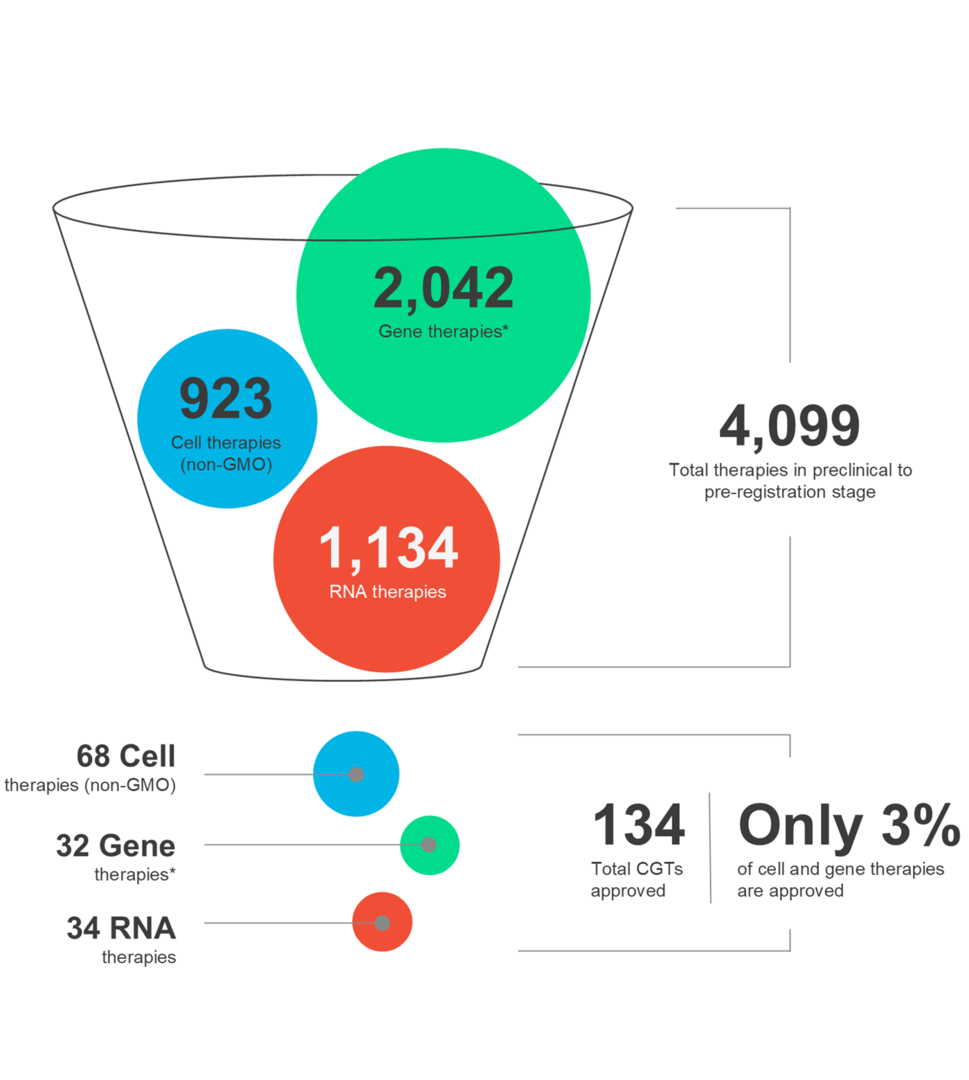
Les thérapies cellulaires et géniques (CGT) façonnent l’avenir de la médecine et offrent un nouvel espoir aux patients du monde entier. Ces thérapies innovantes ont le pouvoir de cibler un large éventail de maladies. Cependant, il est crucial de reconnaître que le paysage de la CGT est dynamique et que le succès thérapeutique nécessite un examen attentif de multiples facteurs tout au long du processus de développement et de distribution des médicaments.
Dans notre dernière infographie, explorez les dernières tendances du marché et les nuances des différentes modalités de CGT, ainsi que des thérapies autologues et allogéniques.

FAQ sur le pipeline de développement de thérapies cellulaires
Quelles thérapies cellulaires sont approuvées ?
Il existe de nombreuses thérapies cellulaires approuvées, par exemple :
- Kymirah (tisagenlecleucel): Un type d'immunothérapie connu sous le nom de thérapie cellulaire CAR-T et il est utilisé pour traiter certains types de lymphome non hodgkinien et de leucémie aiguë lymphoblastique
- Yescarta (axicabtagene ciloleucel): Thérapie cellulaire CAR-T utilisée pour traiter les lymphomes à grandes cellules B après deux lignes ou plus de traitement systémique
- Provenge (sipuleucel-T): Immunothérapie cellulaire autologue indiquée pour le traitement du cancer de la prostate métastatique asymptomatique ou peu symptomatique résistant à la castration
Qu’est-ce que le processus d’approbation de la thérapie cellulaire ?
L’approbation de la thérapie cellulaire implique un processus rigoureux supervisé par des organismes de réglementation tels que la Food and Drug Administration (FDA). Elle commence par des essais précliniques en laboratoire et sur des modèles animaux, suivis d’une demande de nouveau médicament expérimental (IND). S’ils sont approuvés, les essais cliniques sont menés en trois phases pour évaluer l’innocuité, l’efficacité et la posologie. Après l’essai, une demande d’autorisation de mise sur le marché de produits biologiques (BLA) est soumise pour examen. En cas de succès, la thérapie est approuvée pour la mise sur le marché, mais les effets à long terme continuent d’être surveillés.
Combien y a-t-il de thérapies cellulaires approuvées ?
Le nombre de thérapies cellulaires approuvées peut varier d’un pays à l’autre, car chacun a ses propres organismes de réglementation et processus d’approbation. Aux États-Unis, les thérapies cellulaires sont réglementées par la FDA, tandis qu’en Europe, elles relèvent de la compétence de l’Agence européenne des médicaments. Ces organismes ont des critères et des échéanciers différents pour l’approbation. De plus, avec les progrès de la recherche médicale et de la technologie, de nouvelles thérapies cellulaires sont développées et testées en permanence. Par conséquent, le nombre de thérapies cellulaires approuvées ne cesse d’augmenter dans le monde entier.




